Artículos originales
Predictores clínicos de neumonía intrahospitalaria asociada al ictus isquémico agudo
Clinical Predictors of Hospital-acquired Pneumonia Associated with Acute Ischemic
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2015-04-26 10:13:47
Aprobado: 2015-05-20 15:44:11
Correspondencia: Alexis Suárez Quesada. Hospital General Universitario Carlos Manuel de Céspedes. Granma. alexsua.grm@infomed.sld.cu
RESUMEN
Objetivo: identificar los predictores clínicos de neumonía asociada al ictus isquémico agudo.
Método: se estudiaron 201 pacientes pertenecientes a una cohorte prospectiva de estudio con el diagnóstico de ictus isquémico agudo, admitidos de modo consecutivo en la sala de ictus, del Hospital General Universitario Carlos Manuel de Céspedes durante los primeros 7 días a partir de su inicio, desde enero del 2012 hasta diciembre 2013. Los predictores independientes de neumonía intrahospitalaria se obtuvieron usando regresión logística multivariable.
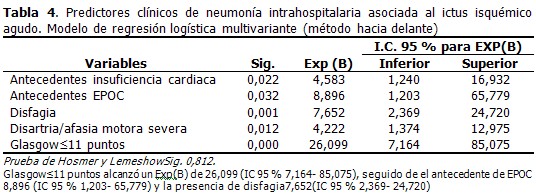
Resultados: el 56,7 % eran del sexo masculino, la media de edad fue 64,17± 14,33 años. La totalidad de casos con neumonía intrahospitalaria asociada al ictus fue de un 19, 9 %. Los sujetos que desarrollaron neumonía tenían más edad (68,55± 13,51 vs. 63,08± 14,36 años), tuvieron menor puntuación en la escala de Glasgow (8,00±2,60 vs. 14,00±2,82), y mayor cifras de leucocitos al ingreso (10,888±3,487 vs. 9,233±2,539× 109/l). Se identificaron los siguientes factores independientes: escala de Glasgow ≤ 11 (OR: 26,099; IC 95 % 7,164- 85,075), historia de enfermedad pulmonar obstructiva crónica (OR: 8,896; IC 95 % 1,203-65,779), disfagia (OR: 7,652; IC 95 % 2,369- 24,720), antecedentes de insuficiencia cardiaca (OR: 4,583; IC 95 % 1,240- 16,932), disartria/afasia motora severa (OR: 4,222; IC 95 % 1,374- 12,975).
Conclusiones: el modelo de regresión logística resultante es un instrumento válido para predecir neumonía postictus basado en los datos disponibles de forma rutinaria.
Palabras clave: neumonía; valor predictivo de las pruebas; infección hospitalaria; accidente cerebrovascular; isquemia encefálica
ABSTRACT
Objective: to identify the clinical predictors of pneumonia associated with acute ischemic stroke.
Methods: a prospective cohort study was conducted in 201 patients diagnosed with acute ischemic stroke consecutively admitted to the stroke unit of the General Carlos Manuel de Céspedes Teaching Hospital during the first seven days after the onset, from January 2012 through December 2013. The independent predictors of hospital-acquired pneumonia were obtained using multivariable logistic regression.
Results: fifty six point seven percent were male. The mean age was 64.17 ± 14.33 years. Cases of hospital-acquired pneumonia associated with stroke accounted for 19, 9 %. Subjects who developed pneumonia were older (68.55 ± 13.51 vs. 63.08 ± 14.36 years), had a lower score in the Glasgow Coma Scale (8.00 ± 2.60 vs. 14.00 ± 2.82), and an increased number of leukocytes at admission (10.888 ± 3.487 vs. 9.233 ± 2.539 × 109/L). The following independent factors were identified: Glasgow Coma Scale ≤ 11 (OR: 26.099; 95 % CI 7.164-85.075), history of chronic obstructive pulmonary disease (OR: 8.896; 95 % CI 1.203-65.779), dysphagia (OR: 7.652; 95 % CI 2.369- 24.720), history of heart failure (OR: 4.583; 95 % CI 1.240- 16.932) and dysarthria/severe motor aphasia (OR: 4.222; 95 % CI 1.374- 12.975).
Conclusions: the resulting logistic regression model is valid for predicting post-stroke pneumonia based on data routinely acquired.
Key words: pneumonia; predictive value of tests; cross infection; stroke; brain ischemia
INTRODUCCIÓN
La enfermedad cerebrovascular representa la tercera causa de muerte a nivel mundial.1 La neumonía intrahospitalaria o nosocomial es un desafío constante debido al espectro microbiológico actual, la resistencia microbiana, su elevada mortalidad, morbilidad y costos hospitalarios.1,2 Los pacientes que sufren un ictus isquémico agudo (IIA) no están exentos de hallarse en esta situación, superando incluso a las complicaciones no infecciosas como la recurrencia del ictus que alcanza un 9 % y los ataques epilépticos con un 3 %.3,4
La incidencia de neumonía intrahospitalaria asociada al ictus (NIHAI) se encuentra estimada entre 5 % y 30 %,3-7 se incrementa hasta tres veces el riesgo de muerte en este grupo de pacientes.8,9 Algunos estudios han identificado varios factores independientes relacionados con la NIHAI, entre ellos los de mayor consistencia son: la disfagia, el deterioro del nivel de conciencia, alta puntuación en la National Institutes of Health Stroke Scale (NIHSS) (por sus siglas en inglés) al ingreso, y una prolongada estadía hospitalaria.2,5-8 Otros factores independientes menos consistentes son la comorbilidad asociada, la edad y el subtipo de ictus.5-8 Sin embargo, recientemente se ha documentado que el daño neurológico agudo induce inmunodepresión que incrementan el riesgo de NIHAI.10-13 No se ha encontrado en nuestro medio estudios que aborden esta problemática.
Motivados por lo expuesto con anterioridad, se decidió realizar esta investigación que tiene como objetivo: identificar los predictores clínicos de neumonía asociada al ictus isquémico agudo.
MÉTODOS
Se realizó un estudio de cohortes única prospectiva en pacientes que recibieron el diagnóstico de IIA en la sala de ictus del Hospital General Universitario Carlos Manuel de Céspedes de la ciudad de Bayamo, provincia de Granma, en el período comprendido desde el 1ro de enero del año 2012 hasta el 31 de diciembre del año 2013, y que tuvieron como complicación la neumonía intrahospitalaria.
Los criterios de inclusión de neumonía intrahospitalaria (NIH) fueron la existencia, luego de las primeras 48 h del ingreso y durante los primeros 7 días, de un infiltrado nuevo en la radiografía de tórax y dos o más de los siguientes: a) temperatura > 38 °C; b) leucocitosis > 10,000 células/ml o leucopenia < 4,000 células/ml; c) esputo purulento (> 25 leucocitos/campo y < 10 células escamosas/campo), y d) ingreso en una unidad de hospitalización convencional; lo anterior se consideró teniendo en cuenta lo planteado por The Centers for Disease Control Nosocomial Infection Definitions.14
Para el diagnóstico del IIA se tuvieron en cuenta los criterios de la actual Guía Cubana de Práctica Clínica para la Enfermedad Cerebrovascular.15 Se excluyeron los pacientes menores de 15 años de edad, pacientes portadores de tumores malignos, historia de ictus isquémico previo, pacientes que fueron admitidos inicialmente en otro Servicio y las gestantes. Ningún paciente recibió ventilación mecánica artificial y todos tuvieron el ictus isquémico agudo como principal diagnóstico al ingreso.
Variables estudiadas: el sexo y la edad en años cumplidos.
Antecedentes patológicos personales: enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), enfermedad renal crónica (ERC) y la insuficiencia cardiaca (IC). Se consideraron al tabaquismo y alcoholismo crónico, entre los hábitos tóxicos.
Las variables clínicas pronósticas al ingreso fueron: la puntuación en la escala de Glasgow, la presencia de disfagia, disartria/afasia motora severa, la cifras de glucemia (mmol/l) y leucocitos (X 109/l), la frecuencia cardiaca, respiratoria y temperatura al ingreso.
Para las variables cualitativas se obtuvieron las frecuencias absolutas y relativas (porcentajes) de las distintas categorías, para las variables cuantitativas se obtuvieron las medias, medianas y desviaciones estándar.
Para valorar la asociación entre las variables cualitativas se empleó el test de Ji-Cuadrado de Mantel. Se utilizó una estrategia univariante basada en la estimación de los porcentajes de enfermos con NIHAI, la tasa de incidencia de la NIHAI tanto en el grupo de expuestos como en los no expuestos, y posteriormente la razón entre incidencias o riesgos relativos (RR) de adquirir NIHAI, se obtuvieron estimaciones puntuales y por intervalo de confianza (del 95 %) de los RR. Para cada variable se probó la hipótesis de que el RR poblacional fuese realmente igual a 1 con un nivel de significación de 0,05. Las variables cuantitativas se categorizaron intentando obtener la mayor asociación estadística y aplicabilidad de los resultados, para llevar a cabo esta conversión se utilizó el procedimiento del punto de corte óptimo o de valor mínimo de p.16 Para la creación del modelo predictivo se realizó un análisis multivariante de regresión logística por pasos hacia delante, usando los datos recogidos del estudio. Se estimaron los odds ratio (OR) puntuales y por intervalos para cada variable (Exp (B)) seleccionada, los que fueron interpretados. La variable dependiente fue la presencia o no de NIHAI. Se evaluó la capacidad del modelo predictivo de diferenciar a los individuos que sufrieron NIHAI de los que no lo sufrieron, asignándole a cada paciente el valor del coeficiente de regresión y se generó la curva receptor-operador (receiver operating characteristic) (ROC) (por sus siglas en inglés).
Antes de ser incluidos en el estudio se les solicitó a cada paciente, o en su defecto al familiar (en caso de deterioro importante de nivel de conciencia o afasia severa), su consentimiento informado verbal y escrito. El estudio, el cual forma parte de un proyecto de investigación de la institución, fue aprobado por el consejo científico y comité de ética del Hospital General Universitario Carlos Manuel de Céspedes, en Bayamo, Granma, que evaluó la calidad metodológica y el cumplimiento de los principios bioéticos.
RESULTADOS
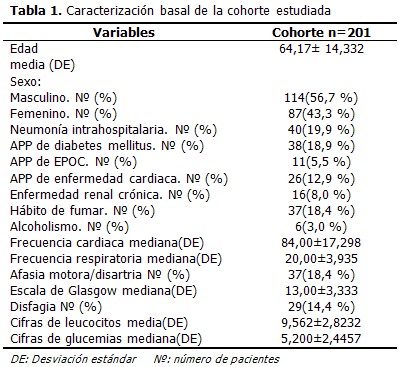
Se muestra la caracterización basal de la cohorte estudiada constituida por 201 pacientes. Predominó el sexo masculino con un 56,7 %, del total de pacientes el 19,9 % sufrió NIHAI, solo el 5,5 % tenía historia previa de EPOC y el 18,4 % eran fumadores. (Tabla 1).
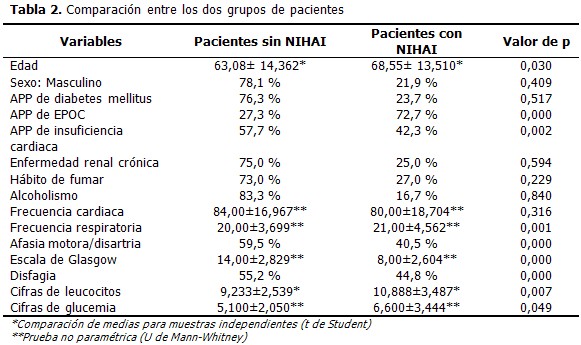
A continuación se relacionan los dos grupos de pacientes. Al comparar el grupo de pacientes que sufrieron NIHAI con los que no presentaron esta complicación, se demostró que existieron diferencias estadísticamente significativas respecto a la edad, antecedentes personales de EPOC y de insuficiencia cardiaca, así como la presencia de afasia motora/disartria, la puntuación de Glasgow, cifras de leucocitos y glucemia al ingreso. Los pacientes con NIHAI tenían más edad (68,55± 13,51) y cifras superiores de leucocitos al ingreso (10,888±3,48). (Tabla 2).
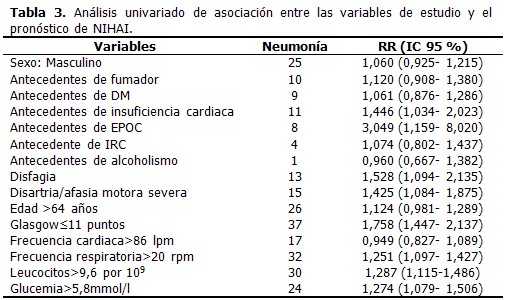
Se resumen los resultados del análisis univariante, el cual demuestra la relación entre cada una de ellas por separado con el pronóstico de NIHAI. Entre los valores de los riesgos relativos se destaca el antecedente de EPOC 3,049 (IC 95 % 1,159- 8,020) y disfagia 1,528 (IC 95 % 1,094- 2,135); cuando la puntuación en la escala de Glasgow fue menor o igual a 11 puntos el pronóstico de NIHAI fue 1,758 veces mayor que los que tuvieron puntuación superior. (Tabla 3).
El resultado del modelo de regresión logística ajustado por el método paso hacia delante, realizado con el objetivo de estimar la función que con menor cantidad de variables lograba un ajuste apropiado, pone de manifiesto que solo con 5 variables se podía cumplir este objetivo. (Tabla 4).
Cuando se probó la capacidad de predecir la aparición de NIHAI, estimada con la función obtenida por el modelo de regresión, se encontró un área bajo la curva ROC significativamente mayor de 0,5 y muy cerca de 1 (0,905 IC 95 % 0,853-0,957), lo que indica una excelente capacidad del modelo para predecir la aparición de ésta complicación. (Tabla 5).
DISCUSIÓN
La identificación de las variables con influencia independiente sobre el pronóstico de NIHAI permite superar la barrera que limita la óptima recuperación del grupo de pacientes con IIA que sufren esta complicación, el reconocimiento oportuno de estas variables hace que esta letal complicación sea potencialmente prevenible y adecuadamente tratada.3 En el presente estudio se obtuvo una función pronóstico basada únicamente en la información aportada por la clínica y los exámenes complementarios disponibles.
Similar a otras investigaciones, tanto en el análisis univariante como en el multivariante, se identificaron una serie de factores pronósticos que incrementaron el riesgo de NIHAI entre los que se destacaron: la comorbilidad asociada, el nivel de conciencia, la disfagia y la severidad de la afasia.2, 4-6
La mayoría de los estudios realizados coinciden en que el nivel de conciencia al ingreso se encuentra entre los factores independientes con mayor capacidad para pronosticar la NIHAI.2, 4, 5, 7,12 Ji R y col. relacionaron la baja puntuación en la escala de Glasgow al ingreso con un alto riesgo de neumonía (OR 1,04; 95 % IC 1,01–1,08; p 0.005).7 Por otra parte, en el trabajo realizado por Li-Fu C17 la puntuación de Glasgow ≤ 9 fue la principal variable pronóstica (Hazard ratio 6,72; 95 % IC 2,12 – 21,30; p 0.001). Estos resultados coinciden con los de esta investigación. El deterioro inicial de la conciencia conduce a una serie de epifenómenos tales como: el empeoramiento de los trastornos del lenguaje y la deglución; que conlleva al uso de sondas nasogástricas, depresión de la función cardiorrespiratoria y con ello a la neumonía aspirativa. A raíz de los recientes trabajos experimentales realizados cabe señalar además, que un menor estado de conciencia supone mayor lesión neurológica aguda conllevando a profundas alteraciones de la respuesta inmune periférica. La fase inicial está caracterizada por una respuesta inflamatoria local y luego generalizada, que resulta en una producción masiva de factores inflamatorios y extravasación de linfocitos en el cerebro. Esta fase temprana de activación es seguida de una inmunosupresión sistémica, denominada inmunosupresión inducida por ictus.11, 13,18
Tanto Li-Fu C y col.17 como Ji R 19 identificaron el antecedente EPOC como variable significativa solo en el análisis invariante; en cambio esta variable tuvo influencia pronóstica independiente en la cohorte de estudio de Ji R y colaboradores7 (OR 1,67; 95 % IC 1,09–2,55; p 0.02). Similares resultados se obtuvieron en nuestro estudio. La EPOC cursa con una inflamación progresiva en las vías aéreas que conduce a destrucción, distorsión y obliteración que hace difícil el reflujo de aire. Esta inflamación alcanza también los alveolos contiguos en donde se exacerba el proceso inflamatorio y conduce a destrucción de la estructura pulmonar y con ello mayor propensión a las infecciones respiratorias.
La disfagia emergió como la tercera variable con influencia independiente. Varios estudios también mostraron resultados similares.2, 7, 20,21 Yapeng identificó a la disfagia como la variable con mayor influencia independiente para el pronóstico (OR 11,76; 95 % IC 7,21-19,19; p <0.001).2 Por su parte, otros autores también tuvieron similares resultados a los nuestros. Li Y (OR 25,51; 95 % IC17, 53-37,12; p 0.001)20 y Zhang X y col. (OR 6,4; 95 % IC2, 10-11,6; p <0.001).21 Los pacientes con disfagia portan una incapacidad orofaríngea funcional, gravedad que puede variar desde una dificultad moderada hasta la total imposibilidad para la deglución. Es responsable de neumonía aspirativa en este grupo de pacientes.
Ji R7 igualmente identificó a la insuficiencia cardiaca como otra variable con influencia independiente (OR 2,15; 95 % IC 1,56–2,95; p <0,001). Este resultado coincide con los obtenidos por otros autores17, 19, 20, 22,23 y por esta investigación. El promedio de edad de los pacientes que constituyeron nuestro estudio, la frecuencia de factores de riesgo para la insuficiencia cardiaca y la frecuencia de ella como comorbilidad, explican los resultados. La congestión vascular con edema pulmonar y la reducción del espacio aéreo por exudado alveolar presentes en la insuficiencia cardiaca crean condiciones favorables para procesos infecciosos.
Se pudo demostrar la influencia de la disartria/afasia motora severa en la aparición de la NIHAI. Esta variable y su influencia en la aparición de esta complicación fue identificada también por Sellars C y col.8 (Exp (B) 3,724; p 0,002) y otros autores como Li-Fu C. 17 La explicación a este resultado se relaciona con los riesgos de pequeñas aspiraciones de la flora nasofaríngea en los casos con severo deterioro del lenguaje, conllevando a un gran riesgo para desarrollar NIHAI.
El modelo de regresión alcanzó un área debajo de la curva de 0,905 con adecuada sensibilidad y especificidad lo cual indica que en nuestra serie de estudio el modelo de regresión resultante pudo pronosticar adecuadamente la aparición de NIHAI.
El modelo de regresión alcanzó un área debajo de la curva de 0,905 con adecuada sensibilidad y especificidad lo cual indica que en nuestra serie de estudio el modelo de regresión resultante pudo pronosticar adecuadamente la aparición de NIHAI. El modelo de regresión logística es un instrumento válido para predecir neumonía postictus basado en los datos disponibles de forma rutinaria.
REFERENCIAS BIBLIOGRÁFICAS
- Carnesoltas L, Serra MA, O’Farrill R. Factores de riesgo y mortalidad por neumonía intrahospitalaria en la Unidad de Terapia Intensiva de Ictus. Medwave. 2013;13(2):1-9 [Buscar en Google Scholar]
- Yapeng l, Bo S, Hui F, Yuan G, Lu Z, Yusheng L, et al. Risk factors for stroke-associated pneumonia in a chinese population: a prospective cohort study. Life Sci J. 2014;11(6):378-82 [Buscar en Google Scholar]
- Langhorne P, Stott DJ, Robertson L, MacDonald J, Jones L, McAlpine C, et al. Medical complications after stroke: a multicenter study. Stroke. 2000;31(6):1223-9 [Buscar en Google Scholar]
- Finlayson O, Kapral M, Hall R, Asllani E, Selchen D, Saposnik G. Risk factors inpatient care, and outcomes of pneumonia after ischemic stroke. Neurology. 2011;77(14):1338-45 [Buscar en Google Scholar]
- Harms H, Grittner U, Droge H, Meisel A. Predicting post-stroke pneumonia: the PANTHERIS score. Acta Neurol Scand. 2013;128(3):178-84 [Buscar en Google Scholar]
- Forti P, Maioli F, Procaccianti G, Nativio V, Lega MV, Coveri M, et al. Independent predictors of ischemic stroke in the elderly: prospective data from a stroke unit. Neurology. 2013;80(1):29-38 [Buscar en Google Scholar]
- Ji R, Shen H, Pan Y, Wang P, Liu G, Wang Y, et al. Novel risk score to predict pneumonia after acute ischemic stroke. Stroke. 2013;44(5):1303-9 [Buscar en Google Scholar]
- Sellars C, Bowie L, Bagg J, Sweeney MP, Miller H, Tilston J, et al. Risk factors for chest infection in acute stroke: a prospective cohort study. Stroke. 2007;38(8):2284-91 [Buscar en Google Scholar]
- Koennecke HC, Belz W, Berfelde D, Endres M, Fitzek S, Hamilton F, et al. Factors influencing in-hospital mortality and morbidity in patients treated on a stroke unit. Neurology. 2011;77(10):965-72 [Buscar en Google Scholar]
- Brämer D, Hoyer H, Günther A, Nowack S, Brunkhorst FM, Witte OW, et al. Study protocol: prediction of stroke associated infections by markers of autonomic control. BMC Neurology. 2014;14(9):1-6 [Buscar en Google Scholar]
- Folyovich A, Biró E, Orbán C, Bajnok A, Varga V, Béres AK, et al. Relevance of novel inflammatory markers in stroke-induced immunosuppression. BMC Neurology. 2014;14(41):1-7 [Buscar en Google Scholar]
- Winklewski PJ, Radkowski M, Demkow U. Cross-talk between the inflammatory response, sympathetic activation and pulmonary infection in the ischemic stroke. J Neuroinflammation. 2014;11(1):213 [Buscar en Google Scholar]
- De Raedt S, De Vos A, Van Binst AM, De Waele M, Coomans D, Buyl R, et al. High natural killer cell number might identify stroke patients at risk of developing infections. Neurol Neuroimmunol Neuroinflamm. 2015;2(2):71 [Buscar en Google Scholar]
- García E, Hernández A, Herrero JA, Gómez J. Protocolo terapéutico empírico de la neumonía nosocomial. Medicine. 2014;11(56):3330-2 [Buscar en Google Scholar]
- Buergo MA, Concepción O, Pérez J, Pando A. Guías de práctica clínica. Enfermedad cerebrovascular. La Habana: ECIMED; 2009 [Buscar en Google Scholar]
- Mazumdar M, Glassman JR. Categorizing a prognostic variable: review of methods, code for easy implementation and applications to decision making about cancer treatments. Stat Med. 2000;19(1):113-32 [Buscar en Google Scholar]
- Chen LF, Chang CY, Hsu LC, Tsai PH, Chang SJ, Chang SC, et al. Bacterial pneumonia following acute ischemic stroke. J Chin Med Assoc. 2013;76(2):78-82 [Buscar en Google Scholar]
- Liesz A, Dalpke A, Mracsko E, Antoine DJ, Roth S, Zhou W, et al. DAMP signaling is a key pathway inducing immune modulation after brain injury. J Neurosci. 2015;35(2):583-98 [Buscar en Google Scholar]
- Ji R, Wang D, Shen H, Pan Y, Liu G, Wang P, et al. Interrelationship among common medical complications after acute stroke: pneumonia plays an important role. Stroke. 2013;44(12):3436-44 [Buscar en Google Scholar]
- Li Y, Song B, Fang H, Gao Y, Zhao L, Xu Y. External validation of the A2DS2 score to predict stroke-associated pneumonia in a chinese population: a prospective cohort study. Plos One. 2014;9(10):1-6 [Buscar en Google Scholar]
- Zhang X, Wang F, Zhang Y, Ge Z. Risk factors for developing pneumonia in patients with diabetes mellitus following acute ischaemic stroke. J Int Med Res. 2012;40(5):1860-5 [Buscar en Google Scholar]
- Arboix A, Masson J, García L, Targa C, Oliveres M. Clinical predictors of prolonged hospital stay after acute stroke: relevance of medical complications. IJCM. 2012;3(1):502-7 [Buscar en Google Scholar]
- Akkoyunlu Y, Öztoprak N, Aydemir H, Pişkin N, Çelebi G, Ankarali H, et al. Risk factors for nosocomial pneumonia in intensive care units of a University Hospital. JMID. 2013;3(1):3-7 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129