Carta al editor
Nuevos avances de la medicina traslacional en el manejo del cáncer de mama: consideraciones sobre el uso de oncovirus
New Advances in Translational Medicine in the Management of Breast Cancer: Considerations on the Use of Oncoviruses
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2024-08-22 01:05:11
Aprobado: 2024-08-28 16:11:15
Correspondencia: Juan Santiago Serna Trejos. Universidad ICESI. Cali. Colombia. juansantiagosernatrejos@gmail.com
Señor Editor:
La medicina traslacional supone una valiosa fuente de conocimientos en la aplicación e integración de diferentes disciplinas médicas en disímiles escenarios sanitarios. En el caso particular de la oncología clínica, la implementación de nuevas terapias dirigidas al tratamiento del cáncer de mama, constituyen un reto interesante e imperativo, dada la alta prevalencia e incidencia de la enfermedad. Solamente en las Américas se estima que más de 491000 mujeres son diagnosticadas con cáncer de mama y cerca de 106000 mujeres mueren por esta causa. Se estima de esta forma que para el año 2040 aumenten casi en un 40 % estas cifras.(1,2)
Los nuevos avances en oncología, han dado a conocer el uso de virus oncolíticos porque centran su acción en la inhibición de puntos de control inmunológico y terapia con células T con receptores quiméricos de antígeno de células T (CAR-T) (por sus siglas en inglés), los cuales corresponden a células T que son extraídas del paciente y posteriormente in vitro se les adiciona un CAR-T que tiene la función de reconocer antígenos de células tumorales que configuran su accionar en el reconocimiento y destrucción de células neoplásicas de forma selectiva y específica.
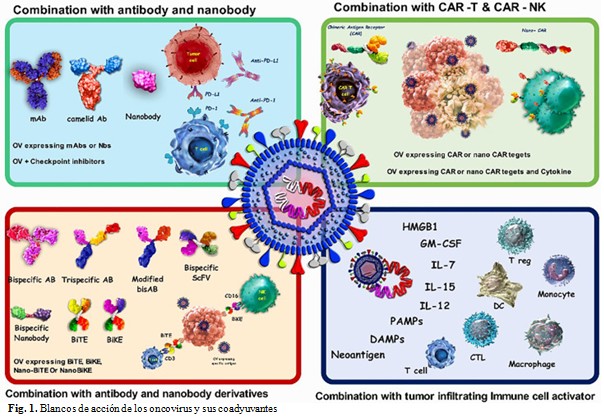
El uso de estos oncovirus fue aprobado por la Administración de Alimentos y Medicamentos (FDA) (por sus siglas en inglés) de los EE. UU. Estos virus actúan de forma similar a la terapia CAR-Ts, puesto que estos virus pueden obtenerse de vida natural o ser diseñados de manera artificial, posteriormente se replican en células cancerígenas y provocan su lisis al generar una regresión tumoral espontánea, con la posibilidad de que no afectan tejido aledaño, al disminuir el control de daños asociados que se obtienen en una terapia convencional de quimioterapia o radioterapia.(3) (Fig. 1).
Los virus oncolíticos generalmente atacan y destruyen las células tumorales. La destrucción de estas células libera neoantígenos, conocidos como patrones moleculares asociados a patógenos (PAMP), que inducen la producción de proteínas virales. Esto a su vez desencadena la generación de citocinas inflamatorias y la liberación de interferones antivirales de tipo I. Los virus también pueden activar vías de muerte celular, lo que da lugar a diferentes formas de muerte celular inmunogénica, como necroptosis, piroptosis, apoptosis inmunogénica y muerte celular autofágica.
Los anticuerpos dirigidos a marcadores en la superficie de células cancerosas (terapia dirigida), a células inmunitarias (inhibición de puntos de control) o a ambos (anticuerpos biespecíficos) son herramientas establecidas en la terapia contra el cáncer. La combinación de virus oncolíticos con anticuerpos y células CAR-T potencia el tratamiento; las células CAR-T se adhieren a los antígenos en la superficie de las células tumorales y las eliminan, pero su avance dentro de la masa tumoral densa para atacar células tumorales que no presentan antígenos es limitado. Por otro lado, las células CAR-NK, que se unen a los ligandos de estrés en la superficie de las células tumorales, muestran una mayor eficacia anticancerígena en comparación con las células CAR-T. El virus oncolítico facilita este proceso al atacar y destruir la estructura densa del tumor.(4)
Estos virus oncolíticos pueden subdividirse en grupos con cepas de virus naturales débiles y virus genéticamente modificados. Dentro del blanco de acción de estos virus, se han buscado “targets” que expresan diferentes neoplasias que expresen genes como el: P53, P16, VHL PTEN, DCC, RAS y RB1. Diferentes tipos de virus han sido empleados en el control de la progresión del cáncer de mama, en el caso particular del Protoparvovirus (H-1PV), consiste en un virus de ácido ribonucleico (ARN) de rata monocatenario que presenta tropismo natural por las células cancerosas humanas pero no se replica ni induce la lisis celular en células no transformadas, que de forma concomitante ofrece acciones de efecto oncosupresor del H-1PV y da como resultado la estimulación de las respuestas inmunes, tanto innatas como adaptativas, como también se ha mostrado su rol versátil en la interacción con las líneas celulares cancerosas derivadas de múltiples tumores, incluidos los cánceres de cerebro, páncreas, pulmón, cuello uterino, colorrectal y mama, así como, melanomas y osteosarcomas, de hecho, son susceptibles a la infección por H-1PV y a la oncólisis. Su mecanismo de acción está orientado a la dirección de células cancerosas explotando receptores sobre expresados como los receptores de proteoglicanos de transferrina y sulfato de heparán, lo que las hace más susceptibles a la infección que las células no cancerosas.(4)
Otro “target” de investigación en el tratamiento del cáncer de mama con oncovirus, respecta al uso de reovirus, los cuales recibieron una aprobación reciente en el 2017, en el cáncer metastásico de mama, su acción concomitante con otros agentes quimiotóxicos ha mostrado desenlaces asociados. Un estudio realizado por Bernstein y cols. mostró que la combinación de reolysin (reovirus) y paclitaxel aumentó significativamente la supervivencia general durante aproximadamente siete meses (HR 0,65; IC del 80 %: 0,46 a 0,91, P = 0,1).(5)
El uso de virus del herpes simple tipo I (HSV-1), se encuentra en fase de estudio para su ejecución, este virus se constituye de un ácido desoxirribonucleico (ADN) bicatenario con una capacidad de infección muy eficaz, por su rol como un efectivo activador de la inmunidad innata y adaptativa. Bajo el nombre comercial de IMLYGIC u OncoVEXGM-CSF, demostró ser seguro y eficaz en pacientes con cáncer de mama refractario.(6,7)
Se ha demostrado que la activación del sistema inmunológico por una infección viral puede provocar la liberación de citocinas y quimiocinas proinflamatorias, lo que da como resultado una respuesta inflamatoria local. Estos aspectos con relación a células no tumorales deben tenerse en cuenta. Lo anterior obedece a que la persistencia de un estado inflamatorio o una inflamación excesiva puede causar daño tisular y exacerbar condiciones patológicas preexistentes.
El seguimiento de diferentes biomarcadores de respuesta puede predecir la respuesta clínica al tratamiento, teniendo en cuenta el microambiente tumoral, se ha mostrado que los tumores con una alta infiltración de linfocitos infiltrantes de tumores (TIL) tienen más probabilidades de responder mejor a la terapia con virus oncolíticos. Los TIL muestran inmunidad preexistente, esencial para la eficacia de virus oncolíticos (VO). Otro biomarcador potencial que puede afectar los resultados del tratamiento es la carga mutacional tumoral (TMB). Los tumores con mayor carga mutacional albergan más neoantígenos, lo que los hace más susceptibles al reconocimiento inmunológico, lo que potencialmente mejora la respuesta a los virus oncolíticos.(8,9,10)
La terapia con virus oncolíticos tienen un gran potencial como terapia contra el cáncer de mama en la actualidad, sin embargo, la terapia con virus modificados genéticamente tiene limitaciones que superar. Una de las primeras dificultades es la entrega de las copias originales. Aunque es posible administrar estos virus por vía intravenosa, existen algunos obstáculos. Los oncovirus en circulación pueden neutralizarse, dado que los anticuerpos preexistentes debido a la inmunización o al tratamiento oncológico previo son el principal problema con la administración sistemática.(11)
En definitiva, el uso de estas terapias puede considerarse como un blanco de acción prometedor en el manejo del cáncer de mama y de neoplasias asociadas que comparten vías genéticas accesorias, se requiere el incentivo de más investigaciones asociadas, orientadas a evaluar la eficacia y la seguridad de su uso.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano.
2. Curación de datos: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano.
3. Análisis formal: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano.
4. Adquisición de fondos: Esta investigación no contó con adquisición de fondos.
5. Investigación: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano, Lina Marcela Ledesma Ruíz.
7. Administración del proyecto: Juan Santiago Serna Trejos.
8. Recursos: Lina Marcela Ledesma Ruíz.
9. Software: Lina Marcela Ledesma Ruíz.
10. Supervisión: Juan Santiago Serna Trejos.
11. Validación: Stefanya Geraldine Bermúdez Moyano.
12. Visualización: Lina Marcela Ledesma Ruíz.
13. Redacción del borrador original: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano.
14. Redacción – revisión y edición: Juan Santiago Serna Trejos, Stefanya Geraldine Bermúdez Moyano, Lina Marcela Ledesma Ruíz.
REFERENCIAS BIBLIOGRáFICAS
1. Organización Panamericana de la Salud. Cáncer de mama. Datos claves[Internet]. Washington:OPS;2023[citado 28/1/2024]. Disponible en: https://www.paho.org/es/temas/cancer-mama.
2. Valdés IP, Ramírez M, Basagoitía A, Testar X, Vásquez JA. Translational medicine and innovation in health: Mechanisms and perspectives. Rev Med Chil[Internet]. 2018[citado 14/2/2023];146(7):[aprox. 8p.]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30534889/.
3. Chen L, Zuo M, Zhou Q, Wang Y. Oncolytic virotherapy in cancer treatment: challenges and optimization prospects. Front Immunol. 2023;14(3):15-6.
4. Jafari M, Kadkhodazadeh M, Shapourabadi MB, Goradel NH, Shokrgozar MA, Arashkia A, et al. Immunovirotherapy: The role of antibody-based therapeutics combination with oncolytic viruses. Front Immunol. 2022;13(10):1-2.
5. Bernstein V, Ellard SL, Dent SF, Tu D, Mates M, Dhesy SK, et al. A randomized phase II study of weekly paclitaxel with or without pelareorep in patients with metastatic breast cancer: final analysis of Canadian Cancer Trials Group IND.213. Breast Cancer Res Treat. 2018;167(2):485-93.
6. Javanbakht M, Tahmasebzadeh S, Cegolon L, Gholami N, Kashaki M, Nikoueinejad H, et al. Oncolytic viruses: A novel treatment strategy for breast cancer. Genes Dis. 2021;10(2):430-46.
7. Leoni V, Gatta V, Palladini A, Nicoletti G, Ranieri D, Dall’Ora M, et al. Systemic delivery of HER2-retargeted oncolytic-HSV by mesenchymal stromal cells protects from lung and brain metastases. Oncotarget. 2015;6(33):34774-87.
8. Kane GI, Lusi CF, Brassil ML, Atukorale PU. Engineering approaches for innate immune-mediated tumor microenvironment remodeling. Immunooncol Technol. 2023;21(1):1-2.
9. Chon HJ, Lee WS, Yang H, Kong SJ, Lee NK, Moon ES, et al. Tumor microenvironment remodeling by intratumoral oncolytic vaccinia virus enhances the efficacy of immune-checkpoint blockade. Clin Cancer Res. 2019;25(5):1612-23.
10. Carvalho FM. Triple-negative breast cancer: from none to multiple therapeutic targets in two decades. Front Oncol. 2023;13(12):1-2.
11. Groeneveldt C, Kinderman P, Griffioen L, Rensing O, Labrie C, van den Wollenberg DJM, et al. Neutralizing Antibodies Impair the Oncolytic Efficacy of Reovirus but Permit Effective Combination with T cell–Based Immunotherapies. Cancer Immunol Res. 2024;12(3):334-49.
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129