Artículos de revisión
La diabetes mellitus tipo 2 y su relación con la obesidad
Type 2 Diabetes Mellitus and its Relationship with Obesity
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2024-05-20 16:20:31
Aprobado: 2024-12-16 20:14:09
Correspondencia: Lina Neri Espinosa Pire. Universidad Regional Autónoma de los Andes. Ambato. Tungurahua. Ecuador. ua.irumaalfonso@uniandes.edu.ec
RESUMEN
Palabras clave: diabetes mellitus tipo 2; obesidad visceral; insulinorresistencia
ABSTRACT
Key words: diabetes mellitus type 2; visceral obesity; insulin resistance
INTRODUCCIóN
La diabetes mellitus es una enfermedad crónica no transmisible que se caracteriza por niveles elevados de glucosa en el torrente sanguíneo. Se han estudiado varios tipos de diabetes mellitus, aunque sus variantes más conocidas son: la diabetes mellitus tipo 1 y la diabetes mellitus tipo 2.
En la diabetes mellitus tipo 1 existe un déficit de insulina como consecuencia de la destrucción de la célula beta pancreática. La diabetes mellitus tipo 2 es la forma más común y con frecuencia se asocia a obesidad o un incremento en la grasa visceral. En esta, el defecto va desde una resistencia predominante a la insulina, acompañada con una deficiencia relativa de la hormona, hasta un progresivo defecto en su secreción.(1)
En los últimos años, se ha observado un incremento en la prevalencia de la diabetes mellitus tipo 2 en Ecuador, estimulado por factores como el envejecimiento de la población, la predisposición genética, la inadecuada alimentación y la falta de actividad física, así como una falta de concienciación y educación sobre estilos de vida saludables. Esta enfermedad es más común en personas de la tercera edad (65 años), por lo que existe una tasa del 20 %. La tasa más alta (75 a 79 años) es de 24,4 %, debido a las mismas causas ya mencionadas.(2)
La diabetes tipo 2 pertenece a un grupo de enfermedades que conducen a la discapacidad debido a diversas complicaciones multiorgánicas, con tasas de morbilidad y mortalidad en aumento en los últimos años, independientemente de las condiciones económicas, culturales o sociales de cada país. Además, se estima que cerca de 4 millones de muertes al año están indirectamente relacionadas con esta condición debido a cambios en el estilo de vida de las personas, relacionados con el sedentarismo, la obesidad, la hipertensión arterial y otros factores de riesgo cardiovascular. Por estos motivos, es la cuarta causa de muerte en el mundo.(2,3)
Las consecuencias de la diabetes tipo 2 son diversas y afectan a casi todos los sistemas de órganos. Las complicaciones crónicas más comunes incluyen enfermedades cardiovasculares, neuropatía, enfermedad renal, retinopatía y enfermedad del pie diabético. Estas complicaciones pueden tener un impacto devastador en la calidad de vida del paciente y, en última instancia, reducen la esperanza de vida.(1,4)
La obesidad es uno de los factores que contribuye significativamente a la aparición de la diabetes mellitus tipo 2 y a pesar de no ser una causa directa, juega un papel crucial en el desarrollo de esta enfermedad, especialmente en personas con predisposición a padecerla.(2,4)
La obesidad visceral o central puede producir resistencia a la insulina, lo que a su vez incrementa la liberación de insulina por las células β del páncreas. Este fenómeno puede mantener inicialmente los niveles de glucosa en sangre dentro de límites normales, pero a largo plazo puede provocar una disfunción de las células pancreáticas y la aparición de diabetes mellitus.(4,5)
En el contexto actual, se está presenciando un aumento de la prevalencia de diabetes tipo 2 y una expansión global de los estados de sobrepeso y obesidad. Estos dos fenómenos están básicamente vinculados, hasta el punto de que el porcentaje de diabetes atribuible al aumento de peso puede llegar a ser superior al 80 % en muchos países.(6)
El rápido crecimiento de la diabetes mellitus no solo es alarmante, también representa un desafío para los sistemas de salud en el mundo, especialmente si se considera que esta enfermedad aumenta el riesgo de padecer cardiopatía isquémica y accidente cerebrovascular. Es por estas razones que surge la necesidad de estudiar de manera exhaustiva las alteraciones fisiopatológicas que hacen de la obesidad la primera causa de diabetes mellitus. Por lo que el objetivo de este estudio es: analizar los aspectos más relevantes y novedosos de la diabetes mellitus tipo 2 y su relación con la obesidad.
DESARROLLO
Para el presente artículo se realizó una revisión bibliográfica actualizada de carácter descriptivo sobre la diabetes mellitus y su relación con la obesidad, durante el mes de octubre del 2023. Se utilizaron metabuscadores como: Accessss, SUMSearch 2 y Epistemonikos y en diversas bases de datos como: Pubmed, INASP, Cochrane, Karger, Embase, PsycINFO y LILACS. Se incluyeron revistas de alto impacto, guías de prácticas clínicas, estudios clínicos aleatorizados, donde se utilizaron palabras claves como: “diabetes mellitus”, “obesidad”, auxiliándose del operador booleano: “AND”.
Se utilizaron como criterios de inclusión: publicaciones actualizadas de los últimos 5 años, artículos de revistas científicas académicas. Se excluyeron aquellas bibliografías con errores conceptuales y/o desactualizadas.
Además, se realizó un flujograma sobre la elección de fuentes. (Fig. 1).
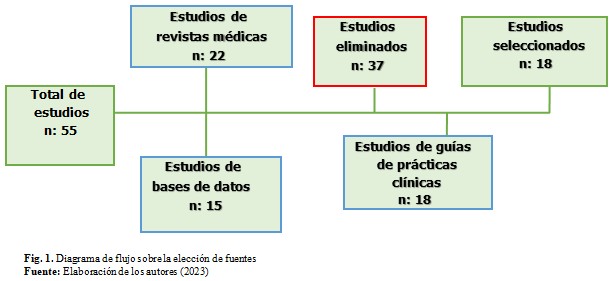
La obesidad es una enfermedad altamente compleja y uno de los factores de riesgo más importantes para el desarrollo de la resistencia a la insulina y la diabetes mellitus tipo 2. La causa principal de la diabetes tipo 2 impulsada por la obesidad es la resistencia a la insulina en el hígado, el tejido adiposo blanco y el músculo esquelético, a lo que se añade una deficiente insulinosecrección por las células del tejido pancreático para superar esta resistencia.(7)
El tejido adiposo es una glándula endocrina que secreta muchas hormonas, citoquinas y sustancias vasoactivas. Además, juega un papel en el balance de energía, mediante la secreción de hormonas como la leptina. Lleva a cabo la lipogénesis y lipólisis. Todas estas funciones del adipocito contribuyen a la sensibilidad a la insulina, la secreción de insulina, la ingesta de alimentos y el gasto energético, y en última instancia, la regulación del peso corporal.(7,8)
Estudios recientes sugieren que uno de los mecanismos que impulsan el desarrollo de la resistencia a la insulina y la diabetes tipo 2 es la inflamación inducida por la obesidad y que esta inflamación está mediada principalmente por las células inmunes en los tejidos locales, en particular el tejido adiposo.(9)
Las citocinas inflamatorias y los ácidos grasos producen resistencia a la insulina. Las señales intracelulares activadas en respuesta a la inflamación inhiben las vías de señalización de la insulina.(9,10)
La insulina al unirse a su receptor activa en la cascada “río abajo” a cinasas de MAP, estas mismas cinasas pueden ser activadas de manera independiente de la insulina por agentes externos, como los productos microbianos, o internos, como las citocinas. Al activarse por vías independientes de la insulina, estas proteínas cinasas generan resistencia a la propia insulina.
El receptor de la insulina es miembro de la familia de receptores con actividad intrínseca cinasa de tirosina y está situado en la superficie de células que dependen de insulina como el hígado, los adipocitos y el músculo; la unión al receptor de insulina estimula su autofosforilación y la de varios sustratos, entre los que se incluyen los miembros de la familia de sustratos de receptor de la insulina (IRS) (por sus siglas en inglés). Existen cuatro isoformas de IRS que coordinan múltiples señales a través de la activación de la vía de fosfatidilinositol 3 cinasa y la vía Grb2/Sos→cascada de Ras; esto inicia los eventos “río abajo” de la señal de insulina, que incluyen los de tipo metabólico y los asociados a mitosis y proliferación celular; las cinasas de MAP participan, sobre todo, en este último tipo de respuesta mencionada y median respuestas celulares que incluyen cambios en la actividad de enzimas metabólicas, en la expresión de genes y en la estructura del citoesqueleto. Las cinasas de MAP incluyen la cinasa aminoterminal Jun (JNK), la cinasa activada por señales extracelulares (ERK) y la cinasa asociada a p85. La inhibición de la señalización activada por el receptor de insulina por citocinas inflamatorias es el primer mecanismo por el que se produce resistencia a la insulina.(9,11)
A medida que la obesidad aumenta, los macrófagos del tejido adiposo (MTA) se activan y producen quimiocinas que reclutan células NK de la circulación. Esto aumenta el número de células NK en la grasa epididimaria. Además, los macrófagos del tejido adiposo en obesos producen IL-15 y los adipocitos producen un ligando aún desconocido para el receptor 1 desencadenante de citotoxicidad natural (NCR1), que activa las células NK en la grasa epididimaria. Entonces, las células NK activadas inducen aumentos en los números MTA y su activación. Esta activación cruzada de los macrófagos y las células NK induce inflamación del tejido adiposo en la obesidad y, finalmente, resistencia a la insulina del adipocito. La grasa epididimaria también produce mediadores que pueden regular la resistencia a la insulina en el hígado y los músculos, lo que finalmente conduce al desarrollo de resistencia a la insulina sistémica.(12)
El tejido adiposo, como ya se ha mencionado a lo largo de esta revisión, se considera uno de los mayores órganos endocrinos en el cuerpo, así como un tejido activo que participa en las reacciones celulares y la homeostasis metabólica, en lugar de ser un tejido inerte encargado únicamente al almacenamiento de energía. En el estado de obesidad, la acumulación excesiva de grasa visceral causa disfuncionalidad del tejido adiposo, que contribuye en gran medida a la aparición de comorbilidades relacionadas con la obesidad. Los mecanismos que subyacen a esta disfunción incluyen: hipertrofia e hiperplasia de adipocitos, aumento de la inflamación, alteración de la matriz de remodelación, fibrosis y secreción alterada de adipocinas.(10,12)
Una de las hormonas más relevantes relacionada con el gasto energético y la función neuroendocrina es la leptina. Esta hormona aumenta sus niveles en estados obesogénicos, está relacionada con el grado de adiposidad y la resistencia a la insulina. Sus funciones son múltiples, entre las que destacan: el control de la presión arterial, la regulación de la oxidación de ácidos grasos en el músculo, ingesta de alimentos y peso corporal.(13)
Otras de las hormonas que participan en el metabolismo de la insulina es el suero de unión a la proteína 4 del retinol, que se eleva en el suero de personas con resistencia a la insulina y algún componente del síndrome metabólico. Por otra parte, omentin-1 juega un papel importante como antiinflamatorio, antioxidante y sensibilizador a la insulina. En la obesidad se reducen sus niveles y se relacionan inversamente con los marcadores del síndrome metabólico.(14)
La resistina es un polipéptido que es secretada por los macrófagos residentes en el tejido adiposo. Sus niveles se incrementan en la obesidad, debido a que está implicada en la fisiopatología de la resistencia a la insulina inducida por inflamación en seres humanos. Esta asociación ha sido confirmada por estudios de casos y controles prospectivos que han encontrado un mayor riesgo de desarrollar diabetes tipo 2 en sujetos con niveles elevados de insulina.(13,14)
Estudios recientes, como la cohorte realizada por Owei, Umekwe y cols.(15) han estudiado además el papel de la resistencia y la sensibilidad a la insulina como predictores de prediabetes y diabetes tipo 2. En su estudio midieron la sensibilidad a la insulina mediante la técnica del clamp hiperinsulinémico-euglucémico y el índice HOMA-IR para distinguir su población de estudio en sensibles o resistentes a la insulina y realizar un seguimiento durante 5,5 años. El fenotipo sensible a la insulina se asoció con un perfil cardiometabólico favorable y protector cardiovascular. En los individuos obesos sensibles a la insulina, el hecho de ser sensibles predice una disminución del 40 % del riesgo relativo de prediabetes y DM tipo 2. El fenotipo resistente a la insulina en personas no obesas presentó un aumento relativo del 80 % de incidencia de prediabetes y DM tipo 2 en comparación con los individuos sensibles, lo cual demuestra que este parámetro predice el 80 % del riesgo.
En un artículo realizado por Villarroya y cols.(16) se demostró la influencia de los dos tipos de tejido adiposo existentes en relación con la diabetes. Se observó que el tejido adiposo blanco está relacionado con el almacenamiento de energía, mientras que el marrón se encarga del gasto energético. Los adipocitos marrones protegen contra la obesidad y los trastornos metabólicos asociados, tales como la hiperglucemia y la hiperlipidemia. En comparación con la grasa blanca, los depósitos de tejido adiposo marrón son menos susceptibles al desarrollo local de la inflamación en respuesta a la obesidad, sin embargo, varios insultos obesogénicos inducen en última instancia un ambiente proinflamatorio en la grasa marrón. Esto altera su actividad termogénica al inferir sobre su mecanismo de gasto de energía y la absorción de la glucosa como sustrato de combustible.
El músculo esquelético es el principal órgano en el que actúa la insulina haciendo que se deposite en él un 80 % de la glucosa que circula en sangre. Cuando los ácidos grasos libres llegan a sus células, bloquean los receptores de insulina, y por lo tanto, disminuye la sensibilidad del tejido a la insulina.(12)
En el hígado, la insulina también desempeña un papel importante, al evitar la degradación de glucógeno al inactivar la fosforilasa hepática, enzima encargada de esta función. También aumenta la actividad de la enzima glucocinasa que permite mayor captación y difusión de glucosa a través de la membrana del hepatocito, lo que permite su depósito en forma de glucógeno.
Cuando este glucógeno supera entre el 5 y el 6 % de concentración, la glucosa adicional que ingresa en el hepatocito se utilizará para la síntesis de grasas. A partir de la glucosa se elaboran ácidos grasos que se empaquetan en triglicéridos y son transportados dentro de lipoproteínas de baja densidad hacia el tejido adiposo donde se depositan como grasa y donde también ejercerá su función la insulina y evita su hidroxilación al inhibir la enzima lipasa que se encarga de este trabajo. Con la disminución de la sensibilidad a la insulina por acción de los ácidos grasos libres, se detienen estos procesos y en su lugar se da paso a la glucólisis y gluconeogénesis que aumentan aún más la glucosa circulante y en el tejido adiposo comienza la lipólisis que favorece mayor liberación de ácidos grasos lo que lleva al organismo a caer en un proceso repetitivo.(17)
La sensibilidad a la insulina reducida en el músculo, hígado y tejido adiposo determina un incremento de la glicemia postprandial, seguido de la glicemia basal que a su vez conduce a un aumento de secreción de insulina para mantener la normoglicemia. Se produce una hiperinsulinemia compensatoria periférica que provoca la disminución del número de receptores de insulina y se agrava de esta manera la resistencia a la insulina. Cuando existe mayor demanda de insulina en situaciones donde exista resistencia a ella, ya sea por una mayor ingesta de calorías, falta de ejercicio, obesidad, etc., el conjunto de células β pancreáticas se ve afectado y se deriva su trabajo a las células β residuales que no han sufrido cambios. Al exceder la carga de trabajo de estas durante algún tiempo se produce una disfunción y/o muerte celular. De esta manera llega un punto en el que se reduce la masa celular total, que no logra compensar las necesidades de insulina lo que conlleva a un hipoinsulinismo y con ello alcanzar niveles de glicemia diagnósticos de DM2.(15,17)
Se ha observado que una dieta baja en calorías ayuda a recuperar valores normales de glucosa en ayunas al cabo de algunos días en personas diabéticas por la reducción de grasa que se produce a nivel del hígado y con ello una mejor sensibilidad hepática a la insulina. En relación con las células β, su función se ha visto recuperada en aproximadamente 8 semanas. Esto conduce a buscar un nuevo enfoque de manejo de DM2 dirigido a conservar la función del hígado, la de las células β pancreáticas y la sensibilidad a la acción de la insulina lo que trae consigo mejores resultados.(18)
CONCLUSIONES
La causa principal de diabetes tipo 2 impulsada por la obesidad es la resistencia a la insulina y una deficiente insulinosecrección por las células del tejido pancreático. La secreción de sustancias como la leptina, resistina, etc., por el tejido adiposo y su inflamación generada por el sobrepeso y la obesidad crea una serie de procesos bioquímicos que provocan resistencia de los tejidos a la insulina. La resistencia a la insulina que se produce, sobre todo, en el tejido adiposo, el hígado y el músculo esquelético genera una disminución de los receptores de insulina, lo cual sumado a una mayor demanda de insulina como puede causar dicha obesidad, hacen que se afecten y mueran las células β del páncreas al generar un estado de hipoinsulinismo e hiperglucemia.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Lina Neri Espinosa Pire, Iruma Alfonso González.
2. Curación de datos: Lina Neri Espinosa Pire, Iruma Alfonso González.
3. Análisis formal: Lina Neri Espinosa Pire, Iruma Alfonso González.
4. Adquisición de fondos: Esta investigación no contó con adquisición de fondos.
5. Investigación: Lina Neri Espinosa Pire, Iruma Alfonso González, Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
6. Metodología: Lina Neri Espinosa Pire, Iruma Alfonso González, Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
7. Administración del proyecto: Lina Neri Espinosa Pire, Iruma Alfonso González.
8. Recursos: Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
9. Software: Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
10. Supervisión: Lina Neri Espinosa Pire, Iruma Alfonso González.
11. Validación: Lina Neri Espinosa Pire, Iruma Alfonso González.
12. Visualización: Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
13. Redacción del borrador original: Lina Neri Espinosa Pire, Iruma Alfonso González.
14. Redacción – revisión y edición: Lina Neri Espinosa Pire, Iruma Alfonso González, Michelle Ariana Calvache Vargas, Holger Alexander Lozano Ati.
REFERENCIAS BIBLIOGRáFICAS
1. Cos AI, Gutiérrez S, Luca B, Galdón A, Chacín JS, Mingo ML, et al. Recomendaciones para la práctica clínica en diabetes y obesidad. Los acuerdos de Madrid. Documento consensuado por los grupos de trabajo de las sociedades científicas: SENDIMAD, SOMAMFYC, SEMG Madrid, SEMERGEN Madrid y RedGDPS. Nutr Hosp[Internet]. 2018[citado 28/10/2024];35(4):[aprox. 7p.]. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212-16112018000800032&lng=es
2. Dávila JX, Montenegro EE, Macías AM, Tayupanda JL. La diabetes mellitus y diabetes gestacional, en adolescente, en el mundo y en el Ecuador, manejo, prevención, tratamiento y mortalidad. RECIMUNDO[Internet]. 2023[citado 28/1/2024];7(2):[aprox. 5p.]. Disponible en: https://recimundo.com/index.php/es/article/view/2024.
3. Our World in Data. Diabetes prevalence[Internet]. England:University Oxford;2023[citado 12/1/2024]. Disponible en: https://ourworldindata.org/grapher/diabetes-prevalence.
4. Monnier L, Colette C. Diabetología. 3rd ed. España:Elsevier España;2020.
5. Gómez F, Abreu C, Cos X, Gómez R. ¿Cuándo empieza la diabetes? Detección e intervención tempranas en diabetes mellitus tipo 2. Rev Clín Esp[Internet]. 2020[citado 12/2/2024];220(5):[aprox. 9p.]. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0014256520300230.
6. Miranda LM, Reza A. Obesidad, inflamación y diabetes. Gac Med Mex[Internet]. 2008[citado 11/9/2023];144(1):[aprox. 10p.]. Disponible en: https://www.anmm.org.mx/GMM/2008/n1/39_vol_144_n1.pdf.
7. Rodríguez C, Celada A, Celada C, Tárraga ML, Romero M, Tárraga PJ. Análisis de la relación entre diabetes mellitus tipo 2 y la obesidad con los factores de riesgo cardiovascular. JONNPR[Internet]. 2021[citado 28/10/2023];6(2):[aprox. 20p.]. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S2529-850X2021000200012&lng=es
8. Rubio M, Cámara R, Merino JF. Obesity and type 2 diabetes: Also linked in therapeutic options. Endocrinol Diabetes Nutr (Engl Ed). 2019;66(3):140-9.
9. Rodas JA, Llerena EV. La obesidad como factor de riesgo asociado a diabetes mellitus tipo 2. Cien Lat[Internet]. 2022[citado 28/10/2023];6(3):[aprox. 12p.]. Disponible en: https://ciencialatina.org/index.php/cienciala/article/view/2216.
10. Drareni K, Ballaire R, Barilla S, Mathew MJ, Toubal A, Fan R, et al. GPS2 Deficiency Triggers Maladaptive White Adipose Tissue Expansion in Obesity via HIF1A Activation. Cell Rep. 2018;24(11):2957-71.
11. Landecho MF, Tuero C, Valentí V, Bilbao I, de la Higuera M, Frühbeck G. Relevance of Leptin and Other Adipokines in Obesity-Associated Cardiovascular Risk. Nutrients. 2019;11(11):2664.
12. Unamuno X, Izaguirre M, Gómez J, Rodríguez A, Ramírez B, Becerril S, et al. Increase of the Adiponectin/Leptin Ratio in Patients with Obesity and Type 2 Diabetes after Roux-en-Y Gastric Bypass. Nutrients. 2019;11(9):2069.
13. Pérez de Carvelli O. Diabetes: Guía de consejos médicos para pacientes y sus familiares. España:Independently Published;2020.
14. Kahn BB. Adipose Tissue, Inter-Organ Communication, and the Path to Type 2 Diabetes: The 2016 Banting Medal for Scientific Achievement Lecture. Diabetes. 2019;68(1):3-14.
15. Owei I, Umekwe N, Provo C, Wan J, Dagogo S. Insulin-sensitive and insulin-resistant obese and non-obese phenotypes: role in prediction of incident pre-diabetes in a longitudinal biracial cohort. BMJ Open Diabetes Res Care. 2017;5(1):e000415.
16. Villarroya F, Cereijo R, Gavalda A, Villarroya J, Giralt M. Inflammation of brown/beige adipose tissues in obesity and metabolic disease. J Intern Med. 2018;284(5):492-504.
17. Núñez S, Delgado A, Simancas D. Tendencias y análisis espacio-temporal de la mortalidad por diabetes mellitus en Ecuador, 2001-2016. Rev Cubana Salud Pública[Internet]. 2020[citado 16/2/2024];46(2):[aprox. 10p.]. Disponible en: https://scielosp.org/article/rcsp/2020.v46n2/e1314/es/#.
18. Zavala A, Fernández E. Diabetes mellitus tipo 2 en el Ecuador: revisión epidemiológica. Mediciencias UTA[Internet]. 2018[citado 28/10/2023];2(4):[aprox. 6p.]. Disponible en: https://revistas.uta.edu.ec/erevista/index.php/medi/article/view/1219.
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129







