Artículos originales
Factores de riesgo de infección asociada al accidente cerebrovascular isquémico en pacientes mayores de 60 años
Risk Factors for Infection Associated with Ischemic Stroke in Patients over 60 Years of Age
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2024-02-23 09:25:22
Aprobado: 2024-08-26 01:13:40
Correspondencia: Alexis Suárez Quesada. Hospital General Universitario Carlos Manuel de Céspedes. Bayamo. Granma. suarezquesadaalexis@gmail.com
RESUMEN
Objetivo: identificar los factores de riesgo de infección asociada al accidente cerebrovascular isquémico en pacientes mayores de 60 años.
Métodos: se realizó un estudio analítico de cohorte prospectiva en pacientes mayores de 60 años con diagnóstico de accidente cerebrovascular isquémico atendidos en el Hospital General Universitario Carlos Manuel de Céspedes del municipio Bayamo, provincia Granma, en el período de tiempo comprendido desde enero del 2018 hasta diciembre del 2022. Se determinó como variable dependiente: infección asociada al accidente cerebrovascular isquémico y como variables independientes, los factores con posible influencia en el desarrollo de la infección asociada al accidente cerebrovascular isquémico. Se determinaron las medias y desviaciones estándar, junto con los valores mínimos y máximos de cada distribución y se obtuvieron frecuencias absolutas y relativas
Resultados: el modelo de regresión logística binaria, ajustado por el método hacia delante, identificó que los factores con influencia independiente son la puntuación de NIHSS > 13 puntos (OR = 18,0; IC 95 % = 7,3 - 44,3; p= 0,000), las enfermedades neurodegenerativas (OR = 17,3; IC 95 % = 3,4 - 87,8; p= 0,001), la disfagia (OR = 6,2; IC 95% = 2,5 - 15,3; p= 0,000) y la fibrilación atrial (OR = 4,2; IC 95% = 1,4 - 12,5; p= 0, 008).
Conclusiones: la gravedad del accidente cerebrovascular isquémico, la coexistencia de enfermedades neurodegenerativas y la disfagia constituyen los principales factores de riesgo de infección asociada al accidente cerebrovascular isquémico en pacientes mayores de 60 años.
Palabras clave: accidente cerebrovascular; infección; neumonía; ictus
ABSTRACT
Objective: to identify risk factors for infection associated with ischemic stroke in patients over 60 years of age.
Methods: a prospective cohort analytical study was carried out in patients over 60 years of age with a diagnosis of ischemic stroke treated at the Carlos Manuel de Cespedes General University Hospital in the municipality of Bayamo, Granma province, in the period of time from January 2018 until December 2022. The dependent variable was determined: infection associated with ischemic stroke and as independent variables the factors with possible influence on the development of infection associated with ischemic stroke. The means and standard deviations were determined, along with the minimum and maximum values of each distribution and absolute and relative frequencies were obtained.
Results: the binary logistic regression model, adjusted by the forward method, identified that the factors with independent influence are the NIHSS score > 13 points (OR = 18.0; 95 % CI = 7.3 - 44.3; p= 0.000), neurodegenerative diseases (OR = 17.3; 95 % CI = 3.4 - 87.8; p= 0.001), dysphagia (OR = 6.2; 95% CI = 2.5 - 15 .3; p= 0.000) and atrial fibrillation (OR = 4.2; 95 % CI = 1.4 - 12.5; p= 0.008).
Conclusions: the severity of ischemic stroke, the coexistence of neurodegenerative diseases and dysphagia constitute the main risk factors for infection associated with ischemic stroke in patients over 60 years of age.
Key words: ischemic stroke; infection; pneumonia; stroke
INTRODUCCIóN
Entre las complicaciones post-accidente cerebrovascular la más importante a nivel mundial es la infección, tanto por su frecuencia, como por estar asociada de manera significativa con pobre recuperación funcional, elevada morbilidad y mortalidad en los pacientes.(1,2)
La infección asociada al accidente cerebrovascular (IAACV) se define como la infección diagnosticada durante el período de hospitalización y ocurre por lo general, en los primeros siete días, su tasa de infección global es de 30 %,(1,3) aunque actualmente se estima una tasa de infección individual del del 33 % para al accidente cerebrovascular isquémico (ACVI) y de 58 % para el accidente cerebrovascular hemorrágico (ACVH).(1,2) Entre las infecciones más frecuentes se encuentran tanto, la infección respiratoria como la del tracto urinario, ambas con un 10 %.(1,2,3)
Se han realizado varias investigaciones con el propósito de identificar los factores de riesgo,(3,4,5,6) dentro de ellos se destacan variables clínicas como la edad avanzada, el sexo masculino, la gravedad del accidente cerebrovascular (ACV) evaluada mediante el National Institutes of Health Stroke Scale (NIHSS) (por sus siglas en inglés), la presencia de disfagia neurogénica; antecedentes como la insuficiencia cardiaca, fibrilación atrial y diabetes mellitus, entre otros.(3,5) Por otra parte, se describen marcadores bioquímicos e inflamatorios como el conteo global de linfocitos, la proporción neutrófilos/linfocitos y plaquetas/linfocitos, entre otros.(6) De igual manera, recientes estudios destacan el impacto del estado nutricional al momento de ACV en el desarrollo de esta complicación.(7)
Aunque evidentemente subyace un estado de inmunodepresión inflamatorio secundario al ACV que puede explicar fisiopatológicamente la predisposición a las infecciones en este grupo de pacientes(8) investigadores continúan la búsqueda de posibles factores que logren predecir con mayor exactitud el desarrollo de esta complicación, sobre todo, en pacientes más vulnerables como son los mayores de 60 años.
En las unidades asistenciales implicadas no se han realizado investigaciones encaminadas a este fin, motivo por el cual se justifica esta investigación, que tiene como objetivo: identificar los factores de riesgo de infección asociada al accidente cerebrovascular isquémico en pacientes mayores de 60 años.
MéTODOS
Se realizó un estudio analítico de cohorte en pacientes con diagnóstico de accidente cerebrovascular isquémico atendidos en los Servicios de Medicina Interna, Neurología, Ictus, Terapia Clínica y Terapia Intermedia del Hospital General Universitario Carlos Manuel de Céspedes del municipio Bayamo, provincia Granma, en el período de tiempo comprendido desde el 1ro de enero del 2018 hasta el 31 de diciembre del 2022.
Criterios de entrada y salida de la cohorte
- Criterios de entrada a la cohorte
- Pacientes con diagnóstico de accidente cerebrovascular isquémico ingresados en Hospital General Universitario Carlos Manuel de Céspedes en el período de tiempo señalado.
- Consentimiento informado del paciente para participar en el estudio, tanto oral como escrito, y en el caso de que el paciente no pudiese cooperar se le solicitó al familiar.
- Criterios de salida de la cohorte
- Los que por voluntad propia decidieron abandonar el estudio.
- Los pacientes que fallecieron en las primeras 72 horas del diagnóstico.
- Pacientes que se trasladaron hacia otro centro hospitalario durante el período de seguimiento.
- Pacientes de 60 años o más, hospitalizados con diagnóstico de accidente cerebrovascular isquémico según los criterios de la American Heart Association/American Stroke Association, (9) con una puntuación en la escala de Glasgow mayor de 9 puntos, en los cuales no se constataron elementos de infección al momento del ingreso.
- Se excluyeron las gestantes, los pacientes portadores del virus de inmunodeficiencia humana (VIH) o el sida definido, pacientes con accidente cerebrovascular isquémico de más de 48 horas de evolución antes de su ingreso hospitalario, así como disfagia preexistente.
Criterios de infección asociada al ictus
La infección asociada al ACVI incluyó la neumonía asociada al ACV, la infección del tracto urinario y otras infecciones (piel, abdominal, ginecológica) desarrolladas en los primeros siete días de ingreso, con síntomas y signos de infección, para lo cual a los pacientes se les realizó un monitoreo de las manifestaciones clínicas, al menos, tres veces al día. Los criterios empleados para definir la neumonía asociada al ictus fueron los propuesto por el grupo de consenso del Diagnosis of Stroke-Associated Pneumonia, Recommendations From the Pneumonia in Stroke Consensus Group (PISCES) (por sus siglas en inglés) que se basaron en criterios clínicos y de imagen.(10) Se consideró infección del tracto urinario y otras localizaciones según los criterios, The US Centers for Disease Control and Prevention criteria 2008 (CDC/NHSN 2008) (por sus siglas en inglés).(11) En todos los casos los autores decidieron incluir el diagnóstico microbiológico.
El tamaño de la muestra para el estudio se determinó mediante el programa estadístico EPIDAT 4.2. Para su estimación se consideraron los siguientes parámetros:
- Nivel de confianza al 95 %.
- Poder del estudio al 80 %.
- Riesgo en expuestos: 38,0 %.
- Riesgo en no expuestos: 25,3 %.
- Razón no expuestos/expuestos: 1,7.
- Riesgo relativo (RR) mínimo a detectar de: 1,5.
Con estas características se calculó una muestra mínima de 449 pacientes, se decidió investigar 490 pacientes que cumplieron con los criterios de inclusión.
Delimitación y operacionalización de las variables
- Variable dependiente: infección asociada al accidente cerebrovascular isquémico (IAACV): sí (1) y no (2).
- Variables independientes: aquellos factores con posible influencia en el desarrollo de la infección asociada al accidente cerebrovascular isquémico, se operacionalizaron como sigue: (1= expuestos. 2 = no expuesto).
- Sociodemográficas: edad≥ 75 años expuesto (1), < 75 años no expuesto (2); sexo masculino expuesto (1), sexo femenino no expuesto (2).
- Comorbilidad: fumador activo, enfermedad alcohólica crónica, enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), insuficiencia cardiaca (IC), cardiopatía isquémica crónica (CIC), ACV previo, fibrilación atrial concurrente, enfermedades neurodegenerativas, enfermedad renal crónica (ERC) moderada-grave, tumor sin metástasis.
- Las referentes al estado neurológico al ingreso: disfagia, puntuación en la escala de NIHSS > 13 puntos, afectación del hemisferio dominante, todas operacionalizadas como variables cualitativas nominales dicotómicas (1) presente y (2) ausentes.
Marcadores biológicos (cuantitativas):
- Conteo global de linfocitos (CGL) < 2200 mm3.
- Proporción plaquetas/linfocitos (PPL) > 100.
- Cifras de alaninaaminotransferasa (ALT o TGP) > 25 UI.
- Cifras de aspartatoaminotransferasa (AST o TGO) > 25 UI.
- Colesterol < 4,8 mmol/L.
- Albúmina sérica < 34 g/L.
- Proteínas totales < 70 g/L.
- Glucemia > 5,5 mmol/L.
- Creatinina > 110 μmol/L.
- Urea > 7 mmol/L.
* Todos considerados como expuestos (1).
Para estimar el riesgo nutricional se empleó el Controlling Nutritional Status (CONUT) (12) > 2 puntos expuesto (1); la muestra de sangre para estos marcadores se obtuvo en las primaras 24 horas de la hospitalización. Los puntos de corte para la dicotomización de cada una las variables biológicas empleados en el análisis estadístico se establecieron de acuerdo con un método para buscar punto de corte óptimo.(11)
El análisis estadístico comenzó con análisis exploratorio y limpieza de los datos, seguido por la caracterización de la muestra, lo que implicó una descripción de todas las variables. Para las variables cuantitativas se determinaron las medias y desviaciones estándar, junto con los valores mínimos y máximos de cada distribución. Para las variables cualitativas se obtuvieron las frecuencias absolutas y relativas (porcentajes).
Se identificó la posible asociación entre las variables consideradas en el estudio y la IAACV, mediante técnicas de análisis bivariado. Para la comparación de frecuencias de los dos grupos de pacientes (con y sin IAACV), se aplicó la prueba de Ji cuadrado de Pearson. Para determinar el grado de asociación de las variables del estudio se calculó el riesgo relativo (RR) con su intervalo de confianza del 95 % (IC 95 %). Para cada variable se probó la hipótesis de que el RR poblacional fuese mayor de 1,5 con un nivel de significación menor de 0,05. Con el propósito de evitar posibles efectos de la colinealidad sobre los resultados del análisis multivariante se realizó la estimación de las correlaciones parciales y del diagnóstico de colinealidad mediante la regresión lineal, se evaluaron todas las variables independientes con relación a la variable dependiente IAACV; para determinar qué variable sería extraída se tuvo en cuenta el valor de la tolerancia y que el valor del factor de inflación de la varianza (VIF) fuera mayor de 2.
Luego, se realizó un modelo de regresión logística binaria primero por el método, introducir para evaluar la posible presencia de interacción entre variables y luego por el método avanzar por pasos con todas las variables que resultaron significativas en el análisis bivariado, para evaluar la asociación de cada variable sobre la probabilidad de desarrollar IAACV, a la vez que se controlaban todas las demás. El ajuste de la función de regresión logística, que equivale a la estimación de sus parámetros se realizó por el método de máxima verosimilitud. El valor de significación límite para la introducción de las variables fue 0,05 y para la salida 0,10. Los coeficientes de las variables introducidas en cada modelo se interpretaron en términos de Odd Ratio (OR) cuyos intervalos de confianza se calcularon al 95 %. Se aplicó la prueba de Hosmer-Lemeshow para evaluar la bondad de ajuste del modelo. Asimismo, se determinó la capacidad predictiva del modelo mediante la curva característica operativa del receptor (COR).
RESULTADOS
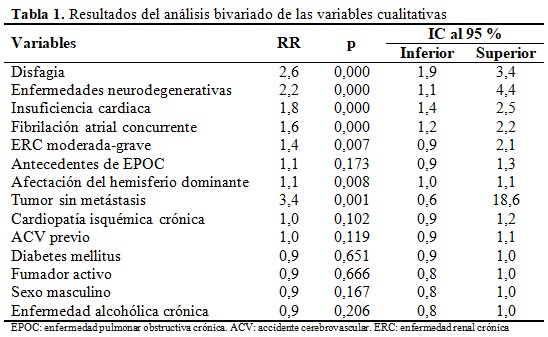
De un total de 14 variables cualitativas examinadas en el análisis bivariado solo cuatro alcanzaron el RR mínimo a detectar para considerarlas como factores de riesgo, entre ellas se destaca la presencia de disfagia al elevar el riesgo de desarrollar IAACV 2,6 veces (IC 95 % = 1,9 - 3,4; p= 0,000), seguido de la enfermedad neurodegenerativa que incrementó el riesgo 2,2 veces (IC 95 % = 1,1 - 4,4; p= 0,000), y posteriormente el antecedente de insuficiencia cardiaca que elevó el riesgo a 1,8 (IC 95 % = 1,4 - 2,5; p= 0,000). El sexo masculino, el antecedente de ser fumador y de diabetes mellitus no se asociaron de manera significativa con la IAACV, tal como se muestra a continuación. (Tabla 1).
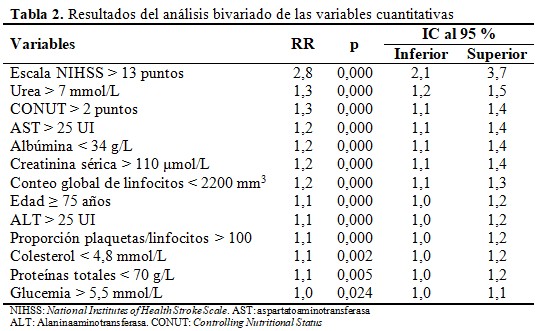
La asociación entre las variables cuantitativas y el riesgo de IAACV se muestra a continuación. Solamente la escala NIHSS > 13 puntos fue el único factor al elevar el riesgo 2,8 veces (IC 95 % = 2,1 - 3,7; p= 0,000). Variables relacionadas con el estado nutricional como el CONUT > 2 puntos y otra indicadoras de disfunción inmunológica como conteo global de linfocitos < 2200 mm3 y la proporción plaquetas/linfocitos > 100 no se asociaron al desarrollo de IACVI. (Tabla 2).
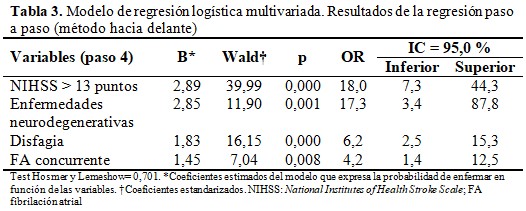
Se muestra el modelo de regresión logística binaria ajustado por el paso a paso (método hacia delante), se realizó con el objetivo de obtener un ajuste apropiado del modelo con la menor cantidad de variables predictoras. Los factores con mayor influencia independiente en el desarrollo de la IAACV fueron la puntuación en la escala de NIHSS > 13 puntos, seguida de la enfermedad neurodegenerativa, la presencia de disfagia neurogénica y posteriormente de FA concurrente. La prueba de Hosmer y Lemeshow con valor de p= 0,701 lo cual indica que el modelo se ajusta adecuadamente a los datos. (Tabla 3).
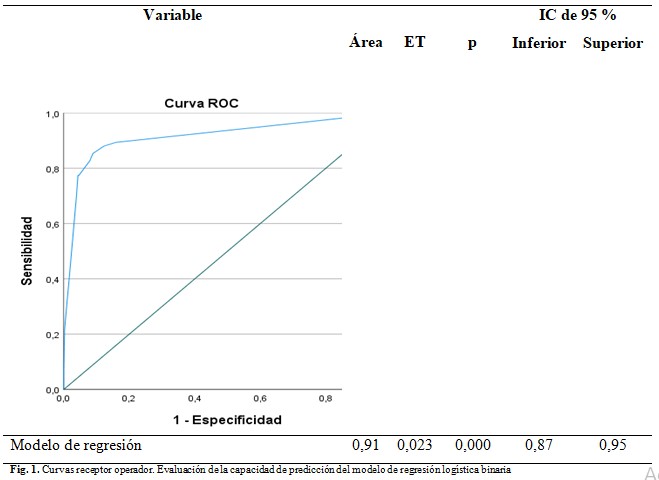
La capacidad discriminativa del modelo, dada por el área bajo la curva COR fue de 0,91 (IC 95 % =0,87 - 0,95; p=0,000), lo cual muestra un buen resultado al ser superior a 0,75. (Fig.1).
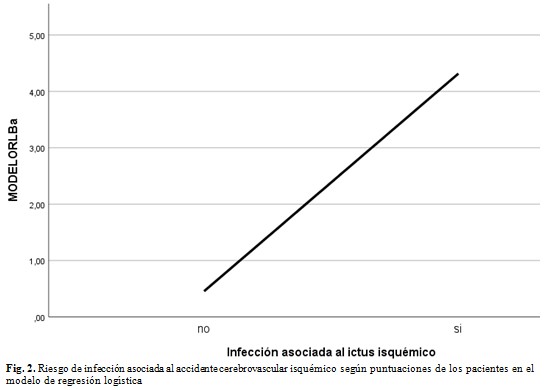
A continuación, se ilustra cómo se incrementa el riesgo de desarrollar IAACV en la medida que aumenta la puntuación del modelo de regresión logística binaria en la muestra de estudio, se observa una relación lineal entre la puntuación y el riesgo de desarrollar esta complicación. (Fig. 2).
DISCUSIóN
La gravedad del ACVI es el factor de riesgo más recurrente en la mayoría de las investigaciones debido a su gran peso desde el punto de vista fisiopatológico en el desarrollo de esta complicación.(4,5,13,14,15) En el modelo de predicción obtenido por Gens y cols.(14) para una puntuación en la escala de NIHSS>7el OR fue de 2,54. Por su parte Zaid Y,(15) en una cohorte de estudio para evaluar la sepsis asociada al ACV, identificó un OR de 7,41 para el ACV de moderado a grave (NIHSS entre 16 y 20), y un OR de 49,09 para el ACV grave (NIHSS entre 21 y 42). Independientemente que estas investigaciones incluyeron pacientes menores de 60 años se puede considerar que esos resultados concuerdan con el presente estudio.
La inmunosupresión asociada al ACV depende de la gravedad evaluada clínicamente mediante la escala de NIHSS, la extensión y ubicación del infarto cerebral. La extensión del infarto tiene como resultado una reducción del tamaño del bazo y de la celularidad esplénica debido a alteraciones en la regulación de los sistemas simpático y parasimpático.(3,8) Por otra parte, tanto los infartos cerebrales extensos, como el ictus grave, se asocian con una mayor producción de interleucina 10 (IL-10), una disminución en la relación Th1/Th2, linfocitopenia y una función deteriorada de los monocitos; de manera que se ha llegado a postular que esta inmunosupresión inducida por el ACV puede constituir una respuesta adaptativa del cerebro al daño cerebral agudo.(3,8)
Se debe destacar también que las personas con enfermedades neurodegenerativas, demencia y otros trastornos cognitivos tienen un mayor riesgo de ser hospitalizados por infección, particularmente por neumonía. Lo anterior es explicado debido a que, además de las características clínicas propias de estas enfermedades que los predispone a la neumonía aspirativa y el cateterismo urinario, el uso frecuente de medicamentos como psicofármacos, sumado a la inmunosenescencia con el remodelado del sistema inmunológico y la elevada prevalencia de múltiples comorbilidades como la diabetes mellitus, asma bronquial, enfermedad arterial coronaria, incrementan tanto el riesgo de desarrollar infecciones como tener una evolución más desfavorable.(8,16,17) En la cohorte de estudio investigada por Järvinen y cols.(17) en el cual comparó 69,350 pacientes con enfermedad de Alzheimer respecto a esa misma cantidad de personas sin esa enfermedad, al ajustar el riesgo de desarrollar neumonía por la comorbilidad obtuvo un riesgo proporcional (HR) de 1,76 (IC 95 % = 1,71 - 1,80). Los argumentos anteriores explican el resultado obtenido en la presente investigación.
La disfagia tiene un papel patogénico importante en el desarrollo de IAACV y su influencia como factor de riesgo se registra de manera constante, con una fuerte asociación en los diferentes estudios.(3,4,5,8,14) En la investigación realizada por Gens R.(14) que tuvo como objetivo evaluar la utilidad de la proporción neutrófilo/linfocito como predictor de infección respiratoria y del tracto urinario en los primeros siete días en pacientes con ACV isquémico, con el empleo de la regresión logística, la disfagia emergió entre los factores con influencia independiente con un OR de 6,40 (IC 95 % = 3,36-12,20; p <0,001).
A juicio de los autores de la actual investigación, son varios los elementos que explican esta fuerte relación de la disfagia con el desarrollo de la IAACV, como son el hecho que un grupo de estos pacientes requieren sonda nasogástrica para garantizar su alimentación, lo que constituye un factor de riesgo para la infección respiratoria; por otra parte, además del agotamiento de la sustancia P, la disfagia post-ACV está explicada por los daños en las áreas cerebrales implicadas en la activación voluntaria, la supervisión y modulación del proceso de la deglución localizados a nivel de la corteza motora primaria, la corteza somatosensorial, la ínsula, la circunvolución frontal inferior, corteza premotora, el área motora suplementaria entre otras; y en las estructuras subcorticales como los ganglios basales, el tálamo además del cerebelo, todo lo cual es un indicador indirecto de la gravedad del ACV, de ese modo su relación con el estado de inmunosupresión inducida por el ACV ya explicado.(3,8) Estos argumentos explican el resultado alcanzado por este estudio.
Entre las enfermedades cardiovasculares, la fibrilación atrial se encuentra entre las que tienen mayor asociación con la IAACV y la infección respiratoria en pacientes con enfermedades neurodegenerativas.(3,5,16,17) Se plantea que la asociación entre fibrilación atrial la IAACV, particularmente con la neumonía asociada al ACV, no es directa, sino que, puede ser de manera secundaria, debido a que estos pacientes tienen múltiples comorbilidades y generalmente están más enfermos. Las explicaciones que tratan de justificar esta asociación advierten que es más probable que la fibrilación atrial ocurra en pacientes de edad avanzada, los cuales puedan ser más frágiles y susceptibles a la NAI(3,8,18) que la actividad atrial irregular puede producir una disminución de la efectividad de la función cardiaca seguida de congestión pulmonar, lo cual puede facilitar la infección respiratoria;(18) la posible influencia de la desregulación del sistema inmunológico y las vías inflamatorias con la posible disminución a la respuesta a agentes infecciosos (tal como se comentó anteriormente).(3,8,18) Los autores de esta investigación coinciden con estos elementos, lo cual explica que resultara una variable con influencia independiente para el desarrollo de la IAACV en este estudio.
En la citada investigación de Gens R y cols.(14) obtuvieron como resultado un modelo de regresión para predecir el desarrollo de la infección respiratoria y del tracto urinario en este grupo de pacientes que constó de cinco factores (edad > 75 años, sexo masculino, disfagia, NIHSS > 7 puntos y proporción neutrófilo/linfocitos ≥ 4,7), se obtuvo un área bajo la curva COR de 0,84 (IC 95 % = 0,79 – 0,89).
Con relación al modelo de regresión resultante en esta investigación también se logró una buena área bajo la curva COR a pesar de que solo coincidieran dos factores en su composición, dicha diferencia está relacionada con las características basales de la población objeto de análisis de la variable edad que fue controlada.
Se identifica el valor que tienen la gravedad del accidente cerebrovascular, el antecedente de enfermedades neurodegenerativas, la presencia de disfagia y de fibrilación atrial en el desarrollo de la infección asociada al accidente cerebrovascular isquémico en pacientes mayores de 60 años. Se obtiene, además, un modelo con capacidad discriminativa adecuada, que puede emplearse para pronosticar la evolución de los individuos con la mencionada enfermedad.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Alexis Suárez Quesada, Alexis Álvarez Aliaga.
2. Curación de datos: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez.
3. Análisis formal: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez.
4. Adquisición de fondos: Esta investigación no contó con adquisición de fondos.
5. Investigación: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez, Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
6. Metodología: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez, Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
7. Administración del proyecto: Alexis Suárez Quesada.
8. Recursos: Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
9. Software: Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
10. Supervisión: Alexis Suárez Quesada.
11. Validación: Alexis Suárez Quesada.
12. Visualización: Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
13. Redacción del borrador original: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez
14. Redacción – revisión y edición: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés José Quesada Vázquez, Eduardo René Valdés Ramos, Ezequiel Ernesto López Espinosa.
REFERENCIAS BIBLIOGRÁFICAS
- Westendorp WF, Nederkoorn PJ, Vermeij JD, Dijkgraaf MG, van de Beek D. Post-stroke infection: a systematic review and meta-analysis. BMC Neurol. 2011;11(1):110 [Buscar en Google Scholar]
- Zhou J, Luo XY, Chen GQ, Li HL, Xu M, Liu S, et al. Incidence, risk factors and outcome of sepsis in critically ill post-craniotomy patients: A single center prospective cohort study. Front Public Health. 2022;10(12):895991 [Buscar en Google Scholar]
- Westendorp WF, Dames C, Nederkoorn PJ, Meisel A. Immunodepression, Infections, and Functional Outcome in Ischemic Stroke. Stroke. 2022;53(5):1438-48 [Buscar en Google Scholar]
- Vermeij JD, Westendorp WF, van de Beek D, Nederkoorn PJ. Post-stroke infections and preventive antibiotics in stroke: Update of clinical evidence. Int J Stroke. 2018;13(9):913-20 [Buscar en Google Scholar]
- Schweizer J, Bustamante A, Lapierre V, Faura J, Scherrer N, Azurmendi L, et al. SAA (Serum Amyloid A): A Novel Predictor of Stroke-Associated Infections. Stroke. 2020;51(12):3523-30 [Buscar en Google Scholar]
- Wang RH, Wen WX, Jiang ZP, Du ZP, Ma ZH, Lu AL, et al. The clinical value of neutrophil-to-lymphocyte ratio (NLR), systemic immune-inflammation index (SII), platelet-to lymphocyte ratio (PLR) and systemic inflammation response index (SIRI) for predicting the occurrence and severity of pneumonia in patients with intracerebral hemorrhage. Front Immunol. 2023;11(15):31 [Buscar en Google Scholar]
- Chen X, Li D, Liu Y, Zhu L, Jia Y, Gao Y. Nutritional risk screening 2002 scale and subsequent risk of stroke-associated infection in ischemic stroke: The REMISE study. Front Nutr. 2022;9(89):5803 [Buscar en Google Scholar]
- Simats A, Liesz A. Systemic inflammation after stroke: implications for post-stroke comorbidities. EMBO Mol Med. 2022;14(9):e16269 [Buscar en Google Scholar]
- Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A, et al. An updated definition of stroke for the 21st century: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44(7):2064-89 [Buscar en Google Scholar]
- Smith CJ, Kishore AK, Vail A, Chamorro A, Garau J, Hopkins SJ, et al. Diagnosis of Stroke-Associated Pneumonia: Recommendations from the Pneumonia in Stroke Consensus Group. Stroke. 2015;46(8):2335-40 [Buscar en Google Scholar]
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control. 2008;36(5):309-32 [Buscar en Google Scholar]
- Akimoto T, Hara M, Morita A, Uehara S, Nakajima H. Relationship between Nutritional scales and prognosis in elderly patients after acute ischemic stroke: Comparison of Controlling Nutritional Status Score and Geriatric Nutritional Risk index. Ann Nutr Metab. 2021;77(2):116-23 [Buscar en Google Scholar]
- Mazumdar M, Glassman JR. Categorizing a prognostic variable: review of methods, code for easy implementation and applications to decision-making about cancer treatments. StatMed. 2000;19(1):113-32 [Buscar en Google Scholar]
- Gens R, Ourtani A, De Vos A, De Keyser J, De Raedt S. Usefulness of the Neutrophil-to-Lymphocyte Ratio as a Predictor of Pneumonia and Urinary Tract Infection Within the First Week After Acute Ischemic Stroke. Front Neurol. 2021;13(12):671 [Buscar en Google Scholar]
- Zaid Y, Rajeh A, Teshnizi SH, Alqarn A, Tarkesh F, Esmaeilinezhad Z, et al. Epidemiologic features and risk factors of sepsis in ischemic stroke patients admitted to intensive care: A prospective cohort study. J Clin Neurosci. 2019;69(3):245-9 [Buscar en Google Scholar]
- Graversen SB, Pedersen HS, Sandbaek A, Foss CH, Palmer VJ, Ribe AR. Dementia and the risk of short-term readmission and mortality after a pneumonia admission. PLoS ONE. 2021;16(1):e0246153 [Buscar en Google Scholar]
- Järvinen H, Tolppanen AM, Hartikainen S. Risk factors of pneumonia in persons with and without Alzheimer’s disease: a matched cohort study. BMC Geriatr. 2023;23(1):227 [Buscar en Google Scholar]
- Schäfer S, Zernecke A. CD8+ T Cells in Atherosclerosis. Cells. 2020;10(1):37 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129