Artículos originales
Biomarcadores de estrés oxidativo en la enfermedad de Huntington y otros desórdenes neurológicos: estudio comparativo
Biomarkers of Oxidative Stress in Huntington's Disease and Other Neurological Disorders: a Comparative Study
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2023-08-09 14:51:31
Aprobado: 2023-11-13 12:34:54
Correspondencia: Marisol Peña Sánchez. Instituto de Neurología y Neurocirugía. La Habana. Cuba. marisol.pena@infomed.sld.cu
RESUMEN
Objetivo: comparar biomarcadores de estrés oxidativo entre pacientes con enfermedad de Huntington y con otros desórdenes neurológicos.
Métodos: se realizó un estudio analítico, retrospectivo y caso-control (enfermedad de Huntington esclerosis lateral amiotrófica, ataxia espinocerebelosa tipo 2 e ictus isquémico: en etapa aguda y crónica). Se recogieron variables demográficas, clínicas y marcadores de daño oxidativo (malonildialdehído, productos avanzados de oxidación a proteínas) y antioxidantes (superóxido dismutasa: catalasa: glutatión peroxidasa, capacidad antioxidante del plasma).
Resultados: hubo diferencias significativas del malonildialdehído en la enfermedad de Huntington respecto al control (p=0,02), pero no con el resto de los grupos. La enzima superóxido dismutasa en enfermedad de Huntington fue menor estadísticamente en comparación con esclerosis lateral amiotrófica, aunque para la catalasa fue superior en relación con el resto de los pacientes. El FRAP en enfermedad de Huntington resultó menor significativamente versus esclerosis lateral amiotrófica e ictus isquémico agudo. Los productos avanzados de la oxidación de proteína se correlacionaron directamente con las edades biológicas y de inicio de la enfermedad de Huntington. La actividad motora en la esclerosis lateral amiotrófica y el déficit neurológico en el ictus isquémico agudo se correlacionaron con el malonildialdehído y glutatión peroxidasa respectivamente.
Conclusiones: la enfermedad de Huntington parece mostrar características específicas en su sistema antioxidante. La oxidación de proteínas pudiera estar relacionada con la acumulación de huntingtina mutada en el tiempo.
Palabras clave: sistema nervioso central; enfermedades no transmisibles; biomarcadores; enfermedad de Huntington; trastorno neurológico
ABSTRACT
Objective: compare biomarkers of oxidative stress between patients with Huntington's disease and other neurological disorders.
Methods: an analytical, retrospective and case-control study was carried out (Huntington's disease, amyotrophic lateral sclerosis, spinocerebellar ataxia type 2 and ischemic stroke: acute and chronic stage). Demographic and clinical variables and markers of oxidative damage (malonildialdehyde, advanced protein oxidation products) and antioxidants (superoxide dismutase: catalase: glutathione peroxidase, plasma antioxidant capacity) were collected.
Results: there were significant differences in malonyldialdehyde in Huntington's disease compared to the control (p=0.02), but not with the rest of the groups. The enzyme superoxide dismutase in Huntington's disease was statistically lower compared to amyotrophic lateral sclerosis, although for catalase it was higher in relation to the rest of the patients. FRAP in Huntington's disease was significantly lower versus amyotrophic lateral sclerosis and acute ischemic stroke. Advanced products of protein oxidation were directly correlated with the biological and onset ages of Huntington's disease. Motor activity in amyotrophic lateral sclerosis and neurological deficit in acute ischemic stroke were correlated with malonyldialdehyde and glutathione peroxidase, respectively.
Conclusions: huntington's disease seems to show specific characteristics in its antioxidant system. Protein oxidation could be related to the accumulation of mutated huntingtin over time.
Key words: central nervous system; non-communicable diseases; biomarkers; huntington's disease; neurological disorder
INTRODUCCIÓN
La investigación de las enfermedades no transmisibles que afectan al sistema nervioso central (SNC) se ha intensificado en los últimos años, con el objetivo de encontrar alternativas terapéuticas que permitan detener o reducir su progresión. En general, la fisiopatología de estas enfermedades es muy compleja porque diversos mecanismos contribuyen a la muerte celular. Por este motivo la dilucidación de los mecanismos bioquímicos que participan en el desarrollo de estas enfermedades es crucial para la búsqueda de biomarcadores y de alternativas terapéuticas eficaces.(1)
La enfermedad de Huntington (EH) es un trastorno neurológico autosómico dominante, raro (5-10/100 000) y degenerativo. Aunque posee tratamiento para el control de algunos de sus síntomas, no tiene terapias eficaces que demoren la progresión o inicio de la enfermedad.(2)
El tratamiento de la EH y otras enfermedades crónicas del SNC se sugiere que no puede abordarse con un solo agente farmacológico.(1) En muchos contextos, la terapia combinada es una opción prometedora, en la que se incluye la neuroprotección. Esta tiene como objetivo fundamental la disminución de la pérdida neuronal, que comienza desde etapas pre-sintomáticas de la enfermedad, a través de la protección del SNC y del fortalecimiento de los mecanismos endógenos que ocasionan neurorregeneración. Entre los mecanismos que intervienen en la neuroprotección, el estrés oxidativo (EO) es uno de los más importantes a considerar.(1)
El estrés oxidativo posee una estrecha relación como entidad generadora de daño en los mecanismos fisiopatológicos de diversas enfermedades, incluidas las neurológicas. Este se define como un trastorno en el control y señalización del estado redox, que se produce por el daño de especies reactivas de oxígeno (ERO) a los principales mecanismos homeostáticos.(3) En el caso de la EH se ha incluido el estudio de marcadores de EO en la predicción del probable curso de la enfermedad, en el monitoreo de etapas de la enfermedad y la evaluación respuestas biológicas de nuevas terapias(4) sin embargo, la naturaleza inespecífica del EO, entre otros motivos han impedido la identificación de algún marcador útil que la diferencie de otras enfermedades. Adicionalmente, el conocimiento del estado redox en la EH y sus diferencias y similitudes con otras enfermedades crónicas del SNC podría contribuir al diseño de estrategias terapéuticas más específicas y efectivas.
En cambio, los estudios comparativos de biomarcadores de EO en pacientes con enfermedades neurológicas como las neurodegenerativas son escasos y controversiales.(5,6,7) Además, que en estos no se encontró ninguno realizado en pacientes con EH, aunque un meta-análisis reciente avala la participación del EO en esta enfermedad.(8) Por tanto, esta investigación tiene como objetivo: comparar parámetros de EO entre pacientes con EH y con otras enfermedades neurológicas.
MÉTODOS
Se realizó un estudio observacional, analítico de corte transversal, retrospectivo con un diseño caso-control, en el que se incluyeron cinco grupos de pacientes con: EH (CAG 36 repeticiones), esclerosis lateral amiotrófica (ELA), ataxia espinocerebelosa tipo 2 (CAG 32 repeticiones), ictus isquémico agudo (1-7 días) e ictus isquémico crónico (1 mes-24 meses). El grupo control estuvo constituido por individuos que asistieron al laboratorio clínico del Instituto de Neurología y Neurocirugía (INN) para la realización de chequeo médico. La investigación se realizó durante el período de abril a diciembre de 2020.
El universo de estudio estuvo constituido por pacientes de diversa procedencia, que asistían a la consulta de enfermedades neurodegenerativas y de enfermedad cerebrovascular atendidos en el INN y de la sala de ictus del Hospital Universitario Clínico Quirúrgico Comandante Manuel Piti Fajardo. La muestra de estudio se conformó por los pacientes que cumplieron con los criterios de inclusión de diagnóstico clínico, radiológico, electrofisiológico y genético según la enfermedad de estudio. Además, se incluyeron hombres y mujeres. Aquellos pacientes y controles con enfermedades asociadas debían estar compensados. Se excluyeron los individuos casos y controles que estuvieran tomando suplementos antioxidantes. Los controles fueron sujetos sin antecedentes personales de enfermedades neurológicas
A todos los pacientes y controles se les realizó examen clínico y neurológico. Dentro de las variables demográficas se recogieron: la edad y sexo de los individuos de los grupos de estudio. Además, se recolectó la información de variables clínicas como: la edad de inicio de la enfermedad, el tiempo de evolución, el número de repeticiones de tripletes CAG y la escala motora de la escala unificada de la EH (UHDRS) (por sus siglas en inglés). Se estudió para la EH: las formas de inicio, tiempo de evolución, edad de la enfermedad y escala para identificar alteraciones bulbar/espinal/motoneurona superior; para la ELA: el estadio clínico, edad de inicio de la enfermedad, tiempo de evolución, número de repeticiones de tripletes CAG; para la ataxia espinocerebelosa tipo 2, escala de déficit neurológico (National Institute of Health Stroke Scale, NIHSS) tiempo de evolución para el ictus isquémico agudo y tiempo de evolución, escala de NIHSS para el ictus isquémico crónico.
Para los estudios de marcadores de EO, los cuales se realizaron a ciegas, se utilizaron dos tipos de muestras biológicas: plasma y lisado de eritrocitos, las que se procesaron en el Centro de Nacional de Genética Médica (CNGM). La extracción de 10 mL de sangre venosa periférica se realizó bajo condiciones de ayuno. La sangre extraída fue dispensada en un tubo con ácido etilendiaminotetraacético (K3EDTA) como anticoagulante. Para el traslado de las muestras se cumplieron con los requerimientos de conservación y una vez en el laboratorio se realizó su procesamiento. La sangre fue centrifugada a 2000 rpm por 10 min. Los fluidos fueron guardados a -20◦C por no más de 30 días hasta el montaje de las técnicas.
Las concentraciones plasmáticas de malonildialdehído (MDA) y los productos avanzados de oxidación de proteína (PAOP) fueron los parámetros de daño oxidativo. Los indicadores de protección antioxidante fueron las enzimas intraeritrocitarias superóxido dismutasa Cu-Zn (CuZn SOD), glutatión peroxidasa (GPx) y catalasa (CAT) y la capacidad antioxidante total del plasma (ensayo FRAP). Los marcadores de EO se llevaron a cabo según lo descrito por Peña-Sánchez y cols.(9)
A las variables estudiadas se les determinó estadística descriptiva, media o mediana, desviación estándar y percentil 10-90 como medidas centrales y de dispersión respectivamente, se tuvo en cuenta la distribución de la variable (Prueba de Kolmogorov-Smirnov). Las variables cualitativas se expresaron en número y porcentaje. La comparación de las variables de EO se realizó por la prueba de Kruskal-Wallis. Para los análisis de asociación de variables se empleó la correlación de Spearman. La significancia estadística se estableció a partir de p<0,05. Los análisis se realizaron con el paquete estadístico (SPSS versión 18.0).
Esta investigación fue aprobada por el comité de ética del INN. Las actuaciones médicas se llevaron a cabo según lo descrito en la Declaración de Helsinki enmendada por la 59 Asamblea General de Seúl, octubre de 2008 y actualizada en el 2013 y el Manual de Ética Médica. Los datos personales de los participantes en el estudio no fueron revelados ni publicados en ninguna etapa de la investigación con el objetivo de mantener la confidencialidad.
RESULTADOS
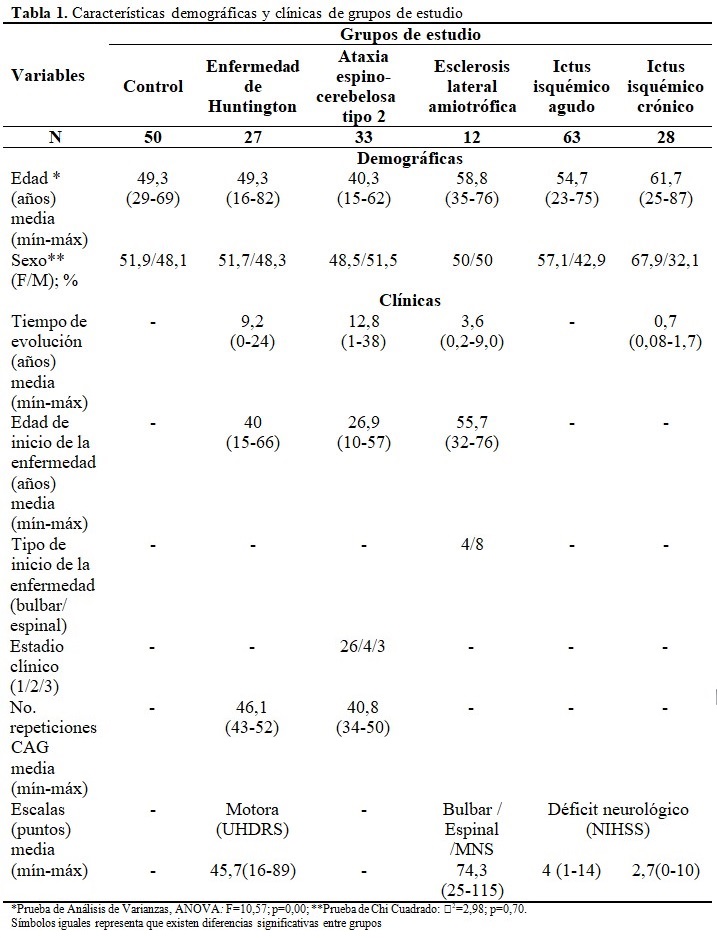
La media de edad de los pacientes con EH solo tuvo diferencias estadísticamente significativas respecto a los pacientes con ictus isquémico crónico. No se halló significación estadística para el género entre los grupos de estudio. El tiempo de evolución de la enfermedad en los pacientes con EH no tuvo diferencias estadísticas comparado con los de ataxia espinocerebelosa tipo 2 (t-student: t=-1,77; p= 0,08), sin embargo, se encontró un aumento significativo de la edad de inicio de la enfermedad en los casos de EH en relación con los de ataxia espinocerebelosa tipo 2 (t-student: t=4,15; p0,001). El número de repeticiones CAG resultó superior estadísticamente en los pacientes con EH en comparación con los de ataxia espinocerebelosa tipo 2 (t-student: t=6,61; p0,0001). (Tabla 1).
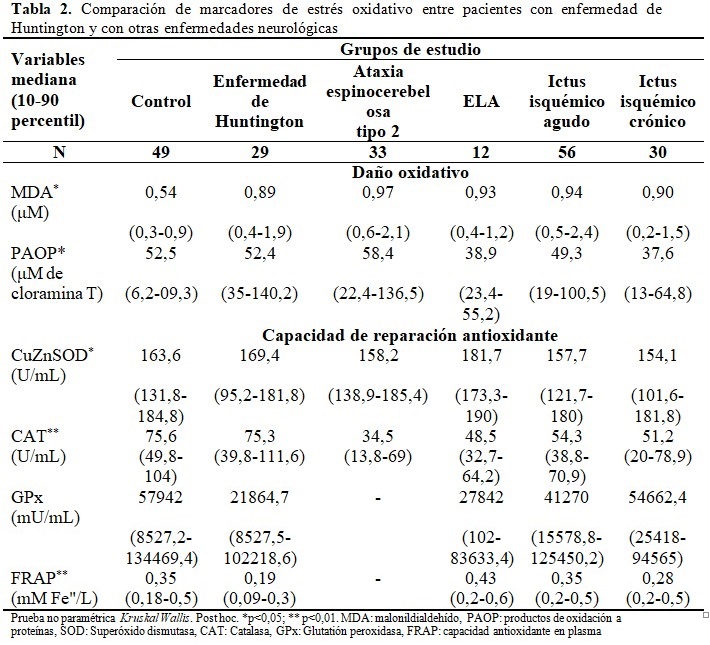
Dentro de los marcadores de daño oxidativo, se observó que las concentraciones de MDA en los casos con EH (EH: p=0,02) y algunos grupos de pacientes (ataxia espinocerebelosa tipo 2: p=0,01; ictus isquémico agudo: p=0,00) se encontraron valores significativamente superiores comparado con los individuos del grupo control, sin embargo, no se hallaron diferencias estadísticas para el PAOP de los pacientes con EH en relación con el resto de los grupos de estudio, incluido los sujetos controles.
A su vez, todas las moléculas con capacidad antioxidante, con la excepción la enzima GPx evidenciaron diferencias significativas desde el punto de vista estadístico. En los pacientes con EH, la SOD mostró una media de actividad significativamente menor respecto solo a los casos de ELA (p=0,02). Mientras que, para la CAT se halló una disminución significativa de la media de esta enzima para todos los grupos de pacientes en relación a los casos de EH (ataxia espinocerebelosa tipo 2: p=0,00; ELA: p=0,01; ictus isquémico agudo: p=0,01; ictus isquémico crónico: p=0,01), pero estos últimos no tuvieron diferencias estadísticas con los individuos controles. Con la capacidad antioxidante en plasma hubo una disminución significativa de las cifras en la EH comparado con los pacientes con ELA (p=0,00), ictus isquémico agudo (p=0,00) y el grupo control (p=0,00). (Tabla 2).
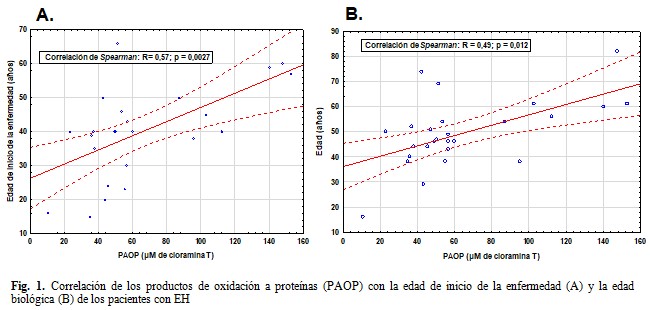
En los casos con EH, se halló una correlación directa significativa entre los PAOP y la edad de inicio y edad biológica de los pacientes. (Fig. 1).
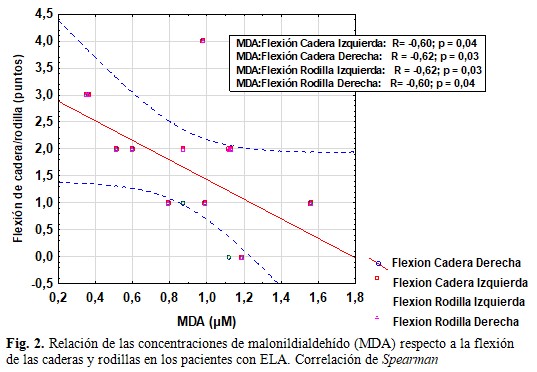
Para la escala espinal de pacientes con ELA, se encontró que las puntuaciones de la flexión/extensión de la cadera y rodilla tuvieron una relación inversa desde el punto de vista estadístico con el incremento de las concentraciones de MDA. (Fig. 2).
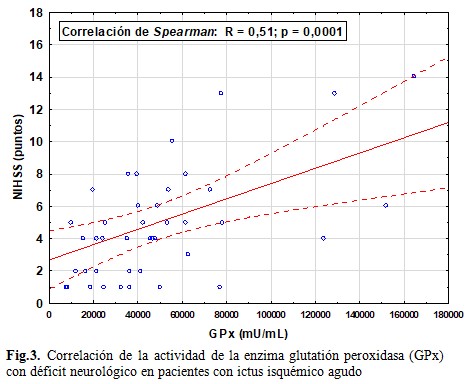
En el ictus isquémico agudo se observó que un incremento significativo de la discapacidad se relacionó con un aumento de la actividad de la enzima GPx. (Fig. 3).
DISCUSIÓN
Las especies reactivas oxidantes se han vinculado a diversas enfermedades neurológicas, las que parecen provocar daño a los tejidos con independencia de las diferentes características clínicas y el curso evolutivo de estos desórdenes. En este sentido en el presente trabajo no se encontraron diferencias en cuanto al daño oxidativo a lípidos en la EH respecto a las demás enfermedades neurológicas ni entre estas. Para algunos aspectos también ocurrió con la oxidación a proteínas. A su vez, con la capacidad antioxidante no se halló afectación de la actividad enzimática en la EH. De hecho, fue mejor la actividad de la CAT respecto al resto de las enfermedades neurológicas estudiadas, sin embargo, solo la capacidad antioxidante plasmática resultó menor en relación a estas enfermedades. Por último, hubo asociación de características de la EH y la ELA con el daño oxidativo a biomoléculas, mientras que para el ictus isquémico agudo se observó con un parámetro de capacidad antioxidante.
A pesar de los escasos trabajos que describen comparaciones de marcadores de EO entre enfermedades neurológicas(6,7) se ha planteado que pueden existir diferencias y semejanzas entre los desórdenes de tipo degenerativos respecto a los de origen vascular.(6) En el trabajo de Serra y cols.(5) observaron que el daño oxidativo a lípidos tanto de enfermedades neurodegenerativas (enfermedad de Parkinson: EP y enfermedad de Alzheimer: EA) como en la demencia vascular fue mayor respecto al de sujetos sanos; fue nuestra evidencia similar a la de estos autores, aunque solo haya sido significativo para la EH, así como para el ictus isquémico agudo y la ataxia. En otro estudio comparativo entre pacientes con EP y ELA se hallaron elevadas concentraciones de MDA respecto a controles, sin diferencias entre estas enfermedades.(7) También en estudios caso-control se ha constatado un incremento del daño oxidativo a lípidos en la EH(8) incluso similar a otras enfermedades neurodegenerativas como señala el metaanálisis de Tang y cols.(8) Mientras que no se evidenció coincidencia con los trabajos comparativos de PAOP ya que estos describen aumento de este marcador en varias enfermedades neurológicas respecto a individuos sanos (EA y EP).(10) En cambio, se plantea que los productos avanzados de glicosilación, los cuales se generan por la glicosilación no enzimática y oxidación de proteínas y lípidos y que se acumulan en varias enfermedades, parece ser mejor marcador durante un daño crónico como las neurodegenerativas.(5,6) Esta pudiera ser la razón de que no se encontraran diferencias para la mayoría de las enfermedades respecto a los individuos controles.
Para las enzimas antioxidantes SOD y CAT, se han hallaron resultados contradictorios en la literatura.(6,7) Al respecto, Serra y cols.(5) observaron actividades elevadas de estas enzimas en enfermedades neurodegenerativas como EP y EA y vasculares en comparación con los controles; lo que no se evidenció en este trabajo para la EH ya que las medias de SOD y CAT no tuvieron diferencias en relación a los sujetos sanos. Por otro lado, se ha referido aumento de la actividad de la CAT con disminución de la SOD en enfermedades neurodegenerativas(6) comportamiento que no se encontró para las incluidas en este trabajo ya que en los pacientes con EH, la SOD tuvo menor actividad en relación con la de pacientes con ELA y con la CAT fue superior en actividad dentro de estos desórdenes.
En la comparación entre enfermedades neurodegenerativas, Baillet y cols.(6) describieron diferencias en las actividades para la SOD entre pacientes con EP y ELA (menor actividad en ELA respecto a EP); pero para la CAT no observaron diferencias en la actividad de la enzima entre ambas enfermedades, lo que no fue consistente con lo descrito en el presente estudio para la ELA. Algunas de estas discrepancias en los resultados, pudieran estar dadas por factores como: diseño de los estudios, métodos de determinación de actividad, la administración concomitante de suplementos antioxidantes, e incluso, de microelementos y minerales. En el caso de este último, se ha detectado que una baja concentración de Zn2+ tiene una posible asociación con la reducida actividad de SOD en pacientes con ELA(6) lo cual pudiera haber influido en las cifras de actividad enzimática de los pacientes ya que solo el 33,3 % tenían tratamientos con suplementos minerales. Por tanto, esto pudiera ser la razón de su actividad variable en estas enfermedades.
También se ha demostrado que existen variaciones de algunas enzimas antioxidantes, con la deficiencia de Cu2+ y Se2+, elementos indispensables de las enzimas antioxidantes SOD y GPx, respectivamente. A pesar de las diferencias y contradicciones sobre estos hallazgos, Serra y cols.(5) sugirieron que las enfermedades que estudiaron (EP, EA y demencia vascular) pudieran presentar similitudes bioquímicas. Estos autores argumentan que las variaciones de las actividades de las enzimas antioxidantes pudieran asociarse con las condiciones clínicas de enfermedades como la demencia vascular y la EA.(5)
Sobre la capacidad antioxidante en plasma, esta puede ser evaluada por diferentes métodos, pero pocos estudios emplean el FRAP para este propósito en enfermedades neurodegenerativas.(11) Medeiros y cols.(11) reportaron por primera vez para esta técnica disminución de la capacidad antioxidante en el plasma en pacientes con EP. En otras investigaciones, en las que se han empleado el método del Trolox o el de quimioluminiscencia, se ha observado una reducción de la actividad antioxidante en EA y en EP en un estudio comparativo(7) ,sin embargo, de las enfermedades neurológicas incluidas en este trabajo solo la EH tuvo una disminución de esta capacidad respecto a la mayoría de los grupos con la excepción de los casos de ictus isquémico crónico, en el cual es reconocida una reducción del contenido de úrico luego de la isquemia. También, Túnez y cols.(12) describieron un comportamiento similar a través de la técnica de inhibición del radical catión [2,2´azinobis (3-etil benzotiazolin-6-sulfonato de amonio] ABTS.
La hiperreactividad del sistema inmune central y periférico esta mediada por los efectos de la proteína huntingtina mutada sobre monocitos y microglía(4) lo que probablemente influya en el incremento de proteínas oxidadas en la EH, corroborado en este estudio a través de la asociación de los PAOP con las edades biológicas y de inicio de la enfermedad.
En la ELA, ocurre afectación de las motoneuronas superiores e inferiores lo que provoca debilidad de grupos de músculos tenar/ primer dorsal interóseos; así como del ángulo dorsiflexor. Esta debilidad es asimétrica, pero los factores que determinan el sitio de inicio de la enfermedad y la dirección de su extensión aún se desconocen. En el incremento de la severidad de la enfermedad medida por la escala funcional de ELA en pacientes con inicio espinal se ha encontrado una asociación directa con el incremento del potencial de óxido-reducción en líquido cefalorraquídeo. Esto sugiere que durante el proceso de envejecimiento en el tejido cerebral también ocurre un daño oxidativo, el cual es probable que no pueda ser contrarrestado y sus efectos conlleven a la neurodegeneración en la ELA.(13) Aunque la escala empleada en esta investigación no fue funcional sino para identificar las alteraciones en el inicio de la enfermedad, parece que la actividad motora se asocia con el incremento del daño oxidativo a lípidos, como fue observado en este estudio, en particular durante la flexión de cadera y rodilla; aunque, no se puede descartar su influencia sobre el resto de regiones afectadas por la enfermedad. De igual manera, es válido señalar que, de los 12 pacientes con ELA, 8 tuvieron presentación espinal, lo cual quizás explique estos hallazgos.
Mientras tanto, en el ictus isquémico agudo fue identificada una relación de la severidad motora con el aumento de la GPx. Aunque Kolesnichenko y cols. en 2008(14) no realizaron una correlación entre GPx y la escala del NIHSS, encontraron un aumento significativo de esta enzima en los pacientes con una presentación del ictus isquémico más severa con respecto a los individuos cuyo déficit neurológico fue menor, sin embargo, no se puede descartar la influencia de la edad y localización del infarto en la severidad del ictus (NIHSS).(14) En el caso del ictus isquémico no agudo puede que el amplio período crónico haya sido una limitante para encontrar asociaciones entre la discapacidad neurológica y los marcadores de EO.
Por tanto, es probable que, en estas enfermedades, las especies reactivas dañen oxidativamente a las biomoléculas del organismo con independencia del estado agudo o crónico de estas. Aunque existen sistemas antioxidantes que convierten estas especies en compuestos menos reactivos, con el fallo de estos pueden acumularse compuestos como sucede en las enfermedades neurodegenerativas. Durante el desbalance oxidativo ocurren mutaciones en varios genes de enzimas antioxidantes, solo que se desconoce si estas anteceden a la enfermedad o se desarrollan en el su transcurso. Entre las enzimas más estudiadas con polimorfismo genético se encuentran la SOD y CAT, y también existen hallazgo con la GPx. Tanto, la deficiencia de CAT como las más de 100 sustituciones de nucleótidos que dan lugar a polimorfismos de la CuZnSOD citoplasmática se han relacionado con los mecanismos fisiopatológicos de estas enfermedades.(15) Además, hay que tener presente la susceptibilidad de estas enzimas a posibles modificaciones oxidativas.
A pesar de las limitaciones del estudio respecto a que los análisis de muestras fueron en diferentes momentos de la investigación, sus resultados crean un precedente para futuros trabajos acerca del tema porque, aun cuando, es reconocida la participación del EO en la fisiopatología de diversas enfermedades, las similitudes y diferencias de este fenómeno no están bien descritas. A su vez, para la EH, la cual no tiene cura en la actualidad, definir el papel de los marcadores de EO en la enfermedad pudiera ser de utilidad como posibles herramientas para el ensayo de nuevas terapias o el seguimiento de estos pacientes.
La EH parece mostrar características distintivas en su sistema de reparación antioxidante comparado con enfermedades similares desde el punto de vista genético como la ataxia espinocerebelosa tipo 2 o diferentes como las de origen vascular. La muestra de estudio con EH no evidenció alteración en las enzimas de primera línea como la SOD y la CAT intraeritrocitarias, mientras que el sistema plasmático antioxidante pudiera alterarse durante el curso de la enfermedad. Además, el incremento de proteína oxidadas clorinadas sugiere la participación de mecanismos inflamatorios que conllevan a la acumulación en el tiempo de huntingtina mutada.
Agradecimientos
A los integrantes del Laboratorio de Bioquímica, otros neurólogos del grupo de enfermedades neurodegenerativas y el de enfermedad cerebrovascular y a todo el personal del Instituto de Neurología y Neurocirugía y el Centro Nacional de Genética Médica que brindaron su apoyo para la realización de esta investigación.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Roles de autoría
- Conceptualización: Marisol Peña Sánchez, Gabriel Andrés Peña de los Santos, Gretel Riverón Forment.
- Curación de datos: Alina González-Quevedo Monteagudo, Tatiana Acosta Sánchez.
- Análisis formal: Marisol Peña Sánchez, Gabriel Andrés Peña de los Santos.
- Adquisición de fondos: Esta investigación no contó con la adquisición de fondos.
- Investigación: Marisol Peña Sánchez, Gretel Riverón Forment.
- Metodología: Marisol Peña Sánchez, Alina González-Quevedo Monteagudo.
- Administración del proyecto: Marisol Peña Sánchez.
- Recursos: Gloria Lara Fernández.
- Supervisión: Alina González-Quevedo Monteagudo, Gloria Lara Fernández.
- Validación: Tatiana Acosta Sánchez.
- Visualización: Tatiana Acosta Sánchez.
- Redacción del borrador original: Marisol Peña Sánchez, Gabriel Andrés Peña de los Santos.
- Redacción – revisión y edición: Marisol Peña Sánchez, Gabriel Andrés Peña de los Santos, Gretel Riverón Forment.
REFERENCIAS BIBLIOGRÁFICAS
- Marmolejo S, Casas C, Gitart R. Endogenous Mechanisms of Neuroprotection: To Boost or Not to Boost. Cells. 2021;10(2):370 [Buscar en Google Scholar]
- Bono J, Gómez AP, Millán JM, Vázquez RP. Reactive Species in Huntington Disease: Are They Really the Radicals You Want to Catch?. Antioxidants (Basel). 2020;9(7):577 [Buscar en Google Scholar]
- Hansen JM, Jones DP, Harris C. The Redox Theory of Development. Antioxid Redox Signal. 2020;32(10):715-740 [Buscar en Google Scholar]
- Zeun P, Scahill RI, Tabrizi SJ, Wild EJ. Fluid and imaging biomarkers for Huntington’s disease. Mol Cell Neurosci. 2019;97(10):67-80 [Buscar en Google Scholar]
- Serra JA, Domínguez RO, de Lustig ES, Guareschi EM, Famulari AL, Bartolomé EL, et al. Parkinson’s disease is associated with oxidative stress:comparison of peripheral antioxidant profiles in living Parkinson’s, Alzheimer’s and vascular dementia patients. J Neural Transm. 2001;108(10):1135-48 [Buscar en Google Scholar]
- Baillet A, Chanteperdrix V, Trocmé C, Casez P, Garrel C, Besson G. The Role of Oxidative Stress in Amyotrophic Lateral Sclerosis and Parkinson’s Disease. Neurochem Res. 2010;35(10):1530-7 [Buscar en Google Scholar]
- Serra JA, Domínguez RO, Marschoff ER, Guareschi EM, Famulari AL, Boveris A. Systemic oxidative stress associated with the neurological diseases of aging. Neurochem Res. 2009;34(12):2122-32 [Buscar en Google Scholar]
- Tang Q, Liu H, Shi XJ, Cheng Y. Blood Oxidative Stress Marker Aberrations in Patients with Huntington’s Disease: A Meta-Analysis Study. Oxid Med Cell Longev. 2020;91(87):195 [Buscar en Google Scholar]
- Peña M, Riverón G, Zaldívar T, Soto A, Borrero J, Lara G, et al. Association of status redox with demographic, clinical and imaging parameters in patients with Huntington’s disease. Clin Biochem. 2015;48(18):1258-63 [Buscar en Google Scholar]
- Krisko A, Radman M. Protein damage, ageing and age-related diseases. Open Biol. 2019;9(3):180249 [Buscar en Google Scholar]
- Medeiros MS, Schumacher A, Machado A, Vargas G, Baldissarelli J, Kegler A, et al. Iron and Oxidative Stress in Parkinson’s Disease: An Observational Study of Injury Biomarkers. PLoS ONE. 2016;11(1):e0146129 [Buscar en Google Scholar]
- Túnez I, Sánchez F, Agüera E, Fernández R, Sánchez FM, Tasset I. Important role of oxidative stress biomarkers in Huntington’s disease. J Med Chem. 2011;54(15):5602-6 [Buscar en Google Scholar]
- Hosaka T, Tsuji H, Tamaoka A. Biomolecular Modifications Linked to Oxidative Stress in Amyotrophic Lateral Sclerosis: Determining Promising Biomarkers Related to Oxidative Stress. Processes. 2021;9(9):1667 [Buscar en Google Scholar]
- Kolesnichenko LS, Kulinsky VI, Shprakh VV, Bardymov VV, Verlan NV, Gubina LP, et al. Glutathione System in Erythrocytes and Blood Plasma in Strokes and Dyscirculatory Encephalopathy. Biomed Khim. 2007;53(4):454-60 [Buscar en Google Scholar]
- Singh A, Kukreti R, Saso L, Kukreti S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 2019;24(8):1583 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129