Artículos originales
Agnosia auditiva y enfermedad de Alzheimer: un estudio de cohortes
Auditory Agnosia and Alzheimer's Disease: a Cohort Study
Cómo citar este artículo:
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

Recibido: 2023-08-01 14:21:39
Aprobado: 2023-11-08 23:49:30
Correspondencia: Manuel Conrado Ezcurdia Bárzaga. Universidad Regional Autónoma de los Andes. Santo Domingo. Ecuador. us.manueleb23@uniandes.edu.ec
RESUMEN
Objetivo: investigar si los pacientes con deterioro cognitivo leve y demencia como síntoma del Alzheimer reconocen los sonidos ambientales peor que las personas cognitivamente sanas.
Método: se realizó un estudio experimental y correlacional con 51 pacientes, diagnosticados con demencia o deterioro cognitivo leve asociados al Alzheimer, en el período comprendido entre 2021 y 2022, en un Centro de Trastornos Cognitivos de un Hospital Público. Se definieron variables cuantitativas para los datos demográficos de la muestra. Se examinaron neuropsicológicamente dos cohortes, 51 pacientes y 27 sujetos de control, con registro de su audición periférica y una prueba de veinte sonidos cotidianos. Se realizó un análisis estadístico de los valores máximos y mínimos, de la varianza y la desviación estándar. Se aplicó la prueba Chi-cuadrado para los niveles de significación entre las variables. Para el procesamiento y normalización de las pistas de audio se empleó el software Audacity Team 2018. Los resultados se presentaron en cantidades.
Resultados: se demostró que los pacientes con Alzheimer presentaban un deterioro relevante a la hora de reconocer sonidos ambientales significativos. Los pacientes con deterioro cognitivo leve y demencia estaban igualmente afectados, lo que puede servir como indicio de que el deterioro auditivo ya está presente en las primeras fases del Alzheimer, también hubo pruebas de reconocimiento de una modalidad específica. Una capacidad reducida para reconocer y clasificar correctamente los sonidos de la vida cotidiana impide la participación y puede conducir a una orientación reducida.
Conclusiones: los pacientes con deterioro cognitivo leve y demencia asociados al Alzheimer suelen presentar agnosia para los sonidos y esto sugiere que las pruebas de ruido ambiental son un método de detección adecuado para las primeras fases de la enfermedad.
Palabras clave: demencia; alzheimer; agnosia auditiva; deterioro cognitivo; rendimiento auditivo periférico
ABSTRACT
Objective: to investigate whether patients with mild cognitive impairment and dementia as a symptom of Alzheimer's recognize environmental sounds worse than cognitively healthy people.
Method: an experimental and correlational study was carried out with 51 patients, diagnosed with dementia or mild cognitive impairment associated with Alzheimer's, in the period between 2021 and 2022, in a Cognitive Disorders Center of a Public Hospital. Quantitative variables were defined for the demographic data of the sample. Two cohorts, 51 patients and 27 control subjects, were neuropsychologically examined, with recording of their peripheral hearing and a test of twenty everyday sounds. A statistical analysis of the maximum and minimum values, variance and standard deviation was carried out. The Chi-square test was applied for the levels of significance between the variables. The Audacity Team 2018 software was used to process and normalize the audio tracks. The results were presented in quantities.
Results: it was shown that Alzheimer's patients presented a relevant impairment when recognizing significant environmental sounds. Patients with mild cognitive impairment and dementia were equally affected, which may serve as an indication that hearing impairment is already present in the early stages of Alzheimer's, there was also evidence of recognition of a specific modality. A reduced ability to correctly recognize and classify everyday sounds impedes participation and can lead to reduced orientation.
Conclusions: patients with mild cognitive impairment and dementia associated with Alzheimer's often present agnosia to sounds and this suggests that environmental noise testing is an appropriate screening method for the early stages of the disease.
Key words: dementia; alzheimer; auditory agnosia; cognitive impairment; peripheral auditory performance
INTRODUCCIÓN
El Alzheimer es una enfermedad neurodegenerativa crónica y progresiva que afecta principalmente a personas mayores. Se caracteriza por una pérdida gradual de las funciones cognitivas, como la memoria, el pensamiento, el razonamiento y la capacidad de aprendizaje. Es la forma más común de demencia y su prevalencia está aumentando a medida que la población envejece.(1)
Uno de los principales desafíos del Alzheimer es su diagnóstico temprano. Los síntomas iniciales, como olvidar nombres o eventos recientes, a menudo se atribuyen al envejecimiento normal y pueden pasar inadvertidos, sin embargo, a medida que la enfermedad avanza, las dificultades para realizar actividades cotidianas, la desorientación en tiempo y espacio y los cambios en el comportamiento y la personalidad se vuelven más evidentes.(2)
La causa exacta del Alzheimer aún no se comprende completamente, pero se cree que la acumulación de placas de proteína beta-amiloide y ovillos de proteína tau en el cerebro desempeñan un papel importante. Estas acumulaciones afectan las conexiones entre las células nerviosas y eventualmente causan su muerte.
El impacto de esta demencia en los individuos y sus familias es profundo. Los pacientes experimentan una disminución en su calidad de vida, así como dificultades para realizar actividades diarias y mantener relaciones sociales. Los cuidadores también enfrentan desafíos significativos, ya que deben brindar apoyo emocional y físico a sus seres queridos mientras enfrentan el estrés y la carga de cuidar a alguien con demencia.
Afortunadamente, a medida que se expande la investigación del Alzheimer, se han desarrollado terapias y enfoques de tratamiento que pueden ayudar a mejorar la calidad de vida de los pacientes. Estos incluyen medicamentos que pueden retardar la progresión de la enfermedad y terapias no farmacológicas, como la estimulación cognitiva y la terapia ocupacional. El diagnóstico precoz del Alzheimer y sus fases preliminares es elemental para iniciar a tiempo las terapias y permitir así una mayor participación en la vida cotidiana.
Pruebas recientes sugieren que el daño debido a la enfermedad puede provocar agnosia a los sonidos en pacientes con enfermedad de Alzheimer.(2) La agnosia a los sonidos, específicamente a los ruidos, como subtipo de los trastornos del procesamiento y la percepción auditivos, conlleva una difícil comprensión de los sonidos ambientales cotidianos con una audición periférica intacta y puede adquirirse por daños patológicos en los sistemas auditivos centrales.(3)
El objetivo del presente estudio es determinar si existen diferencias en el reconocimiento de sonidos ambientales significativos entre pacientes con deterioro cognitivo leve y demencia como posibles síntomas previos o asociados al Alzheimer y sujetos de control cognitivamente sanos. Como una perspectiva adicional para futuras investigaciones, se explora la cuestión de cómo mejorar las pruebas actuales de los sonidos ambientales mediante el aumento de la consistencia interna de la prueba y por lo tanto de la precisión de la medición.
MÉTODOS
El presente estudio es un cuasi experimento, con repetición de mediciones de sonidos ambientales. El estudio tuvo lugar en un Centro de Trastornos Cognitivos de un Hospital Público. Tras informar a los participantes y obtener su consentimiento, se recogieron sus datos demográficos. En primer lugar, se realizaron pruebas neuropsicológicas, seguidas del examen de la audición periférica. Las pruebas posteriores de sonidos ambientales se realizaron en cinco pasadas.
Este estudio incluyó a 51 pacientes en el período comprendido entre 2021 y 2022. Los pacientes fueron diagnosticados con demencia o deterioro cognitivo leve (DCL) como manifestaciones de la enfermedad de Alzheimer (EA) sobre la base de una historia clínica detallada, un examen físico, pruebas neuropsicológicas, imágenes cerebrales, y en algunos casos, determinación de marcadores de neurodegeneración en el líquido cefalorraquídeo.
En función de la edad al inicio de los primeros síntomas de demencia, los pacientes fueron diagnosticados de EA de inicio precoz (EOAD) (por sus siglas en inglés), al inicio de los síntomas menores de 65 años o de EA de inicio tardío (LOAD) (por sus siglas en inglés), al inicio de los síntomas a partir de los 65 años. Si, además, de la enfermedad de Alzheimer había microangiopatía cerebral, se diagnosticaba demencia mixta. Los criterios de exclusión incluían otras formas de demencia, pérdida auditiva profunda (≥ grado 3 de la OMS) y enfermedad mental.
En el estudio se incluyeron 27 sujetos de control, entre los que se encontraban familiares cognitivamente sanos de los pacientes y visitantes. Los controles sanos tenían la misma edad y sexo. Entre los criterios de exclusión se incluían la pérdida de audición grave (≥ grado 3 de la OMS) y las enfermedades mentales. La inclusión de los participantes tuvo lugar tras una información detallada y un consentimiento por escrito.
Pruebas neuropsicológicas
Las pruebas neuropsicológicas específicas del estudio se realizaron con la batería de pruebas neuropsicológicas: Consortium to Establish a Registry for Alzheimer's Disease (CERAD),(4) (por sus siglas en inglés), además, el nivel de depresión se determinó utilizando la versión abreviada de la Escala de Depresión Geriátrica (GDS), (por sus siglas en inglés).(5)
Pruebas de audición periférica
Los participantes recibieron unos auriculares audiométricos, se reprodujo una prueba de audición (audiograma de tonos puros) mediante la aplicación Hearing Test Pro para Android. Los auriculares fueron previamente equipados con una toma auxiliar por el departamento técnico local. El umbral de audición se determinó preguntando si los respectivos sonidos reproducidos aún podían oírse. Las frecuencias de 125 Hz, 250 Hz, 500 Hz, 1000 Hz, 2000 Hz, 3000 Hz, 4000 Hz, 6000 Hz y 8000 Hz se probaron por separado para ambos oídos.
Preparación del ruido ambiental
Se llevó a cabo en primer lugar una correlación sonido-escala para determinar el poder discriminatorio. Los que no contribuyeron a una mayor diferenciación se eliminaron de la batería de pruebas. En un segundo paso, se clasificaron en niveles de dificultad en función de la frecuencia con la que se reconocían. Se encontraron pocos con una dificultad media. La batería de pruebas se amplió en cinco sonidos con el fin de lograr posiblemente una dificultad más equilibrada. Cabe mencionar que los nuevos sonidos tenían una dificultad desconocida en el momento de su introducción. A la hora de seleccionarlos, se eligieron sonidos animados y sonidos inanimados. Se añadieron los siguientes sonidos a la lista de sonidos del estudio piloto: máquina de vapor, sierra, gato, tormenta y caballo. De forma resumida la clasificación de los distintos niveles de dificultad para los sonidos ambientales fue la siguiente:
- Nivel de dificultad fácil: perro ladrando, martinshorn, housebell, campanas de iglesia, claxon del coche.
- Nivel de dificultad media: teléfono, descarga del inodoro, coche que pasa, birdsong, timbre de bicicleta.
- Nivel de dificultad difícil: secador de pelo, tormenta eléctrica, aspiradora, andicador de coche, lluvia.
- Nueva: locomotora de vapor, gato, tormenta, caballo.
Los sonidos ambientales se clasificaron, además, en tres categorías:
- Sonidos de la naturaleza.
- Sonidos ambientales.
- Sonidos domésticos.
Según su importancia en relación con el contenido. De forma resumida la clasificación del ruido ambiental en categorías quedó establecido así:
- Naturaleza: perro ladrando, canto de pájaros, gato, tormenta, caballo, tormenta eléctrica, lluvia.
- Ambientales: martinshorn, campanas de iglesia, claxon del coche, coche que pasa, timbre de bicicleta, indicador de coche, locomotora de vapor.
- Domésticos: timbre de la casa, teléfono, descarga del inodoro, Secador de pelo, Aspiradora.
Las pistas de audio de los sonidos se aislaron, primero, como pistas monoaurales al utilizar el programa informático Audacity Team 2018 y se normalizaron a -1 dB mediante transformación lineal. En este caso, la normalización de audio se define como un proceso de elevación de la amplitud a un nivel constante. De este modo, se puede lograr una sonoridad uniforme en diferentes archivos de audio. En los pasos siguientes, cada una de las pistas se amplificó en 5 dB y en 10 dB para garantizar un aumento uniforme del volumen durante la reproducción durante la prueba. Las pistas de audio se guardaron en WAVEform audio format, (WAV) (abreviatura del término en inglés) de 32 bits en coma flotante para aprovechar el rango dinámico y mantener bajo el recorte.
Prueba de los sonidos ambientales
En primer lugar, se reprodujo una mezcla de frecuencias denominada ruido rosa a los participantes como un tono ligero mediante los altavoces. Una persona normal percibe todos los rangos de frecuencia del espectro sonoro audible como aproximadamente igual de fuertes.(6) Debido a esta propiedad, el ruido rosa es adecuado para la adaptación del volumen. El ruido rosa se generó con el programa informático Audacity Team. El nivel de ruido del tono luminoso se midió en el oído de los participantes mediante la aplicación para Android, OpeNoise y la reproducción se ajustó a 65 dB en el altavoz. Los sonidos ambientales se reprodujeron a través de altavoces multimedia Philips 2.0 en una sala silenciosa.
RESULTADOS
Resultados de los datos demográficos, nivel de depresión y el rendimiento auditivo periférico
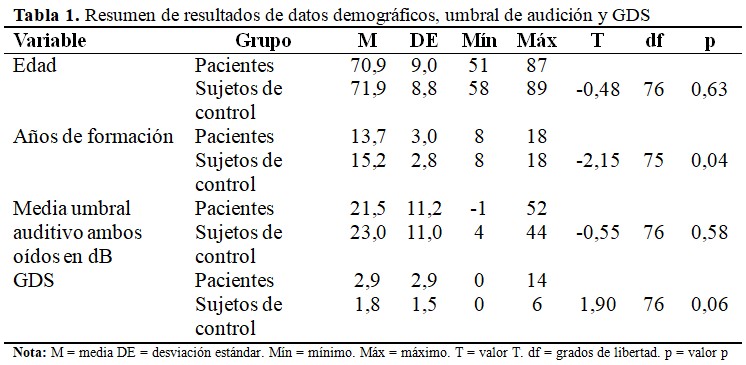
Se incluyeron en el estudio 51 pacientes, 10 de los cuales tenían un diagnóstico de DCL en la EA, 9 de demencia mixta de Alzheimer, 14 de EOAD y 18 de LOAD. Se incluyeron un total de 28 sujetos de control, un sujeto de control tuvo que ser excluido debido a que faltaba una prueba de sonido, por lo que los datos de 27 sujetos de control se incluyeron en el análisis. Participaron en el estudio 31 pacientes de sexo femenino y 20 de sexo masculino, así como 14 sujetos de control de sexo femenino y 13 de sexo masculino. No hubo diferencias significativas en la distribución por sexos entre los grupos (χ² = 0,57; p = 0,45). Solo se encontraron diferencias significativas entre los grupos con respecto a los años de educación, donde los sujetos de control tenían una media de 1,5 años más de nivel educacional. Las diferencias en edad, depresión, mediante GDS y umbral auditivo medio para ambos oídos en dB no fueron significativas. (Tabla 1).
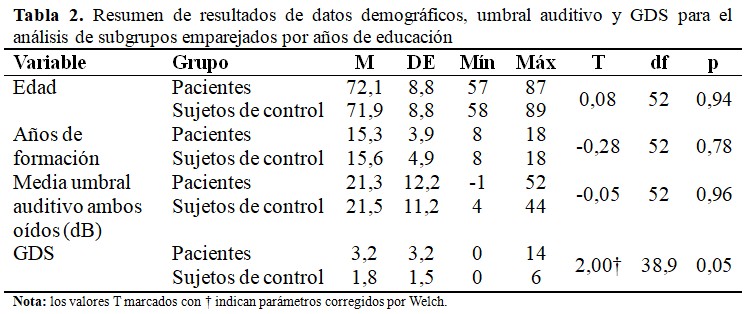
La comparación de subgrupos entre los sujetos de control y los pacientes emparejados en términos de años de educación (N = 27 cada uno) no tuvo diferencias significativas. Del mismo modo, las diferencias en edad, nivel de depresión según GDS y umbral auditivo medio para ambos oídos en dB no fueron significativas. (Tabla 2).
Resultados del examen neuropsicológico
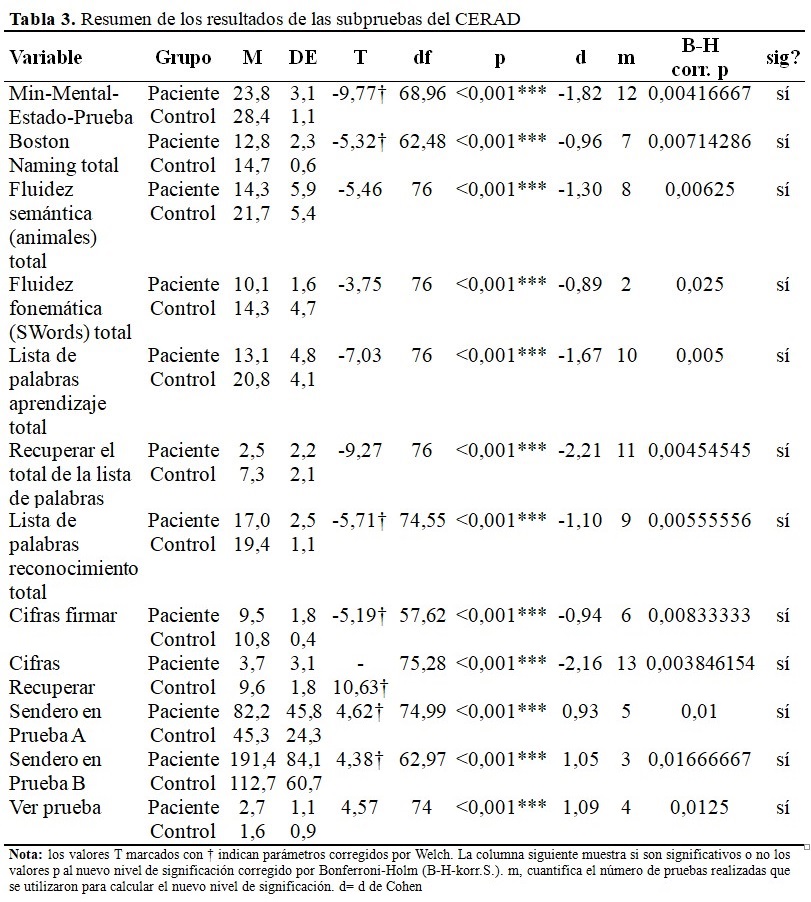
Los sujetos de control obtuvieron resultados significativamente mejores en todas las subpruebas de la batería de pruebas CERAD. (Tabla 3).
Resultados de la prueba de ruido
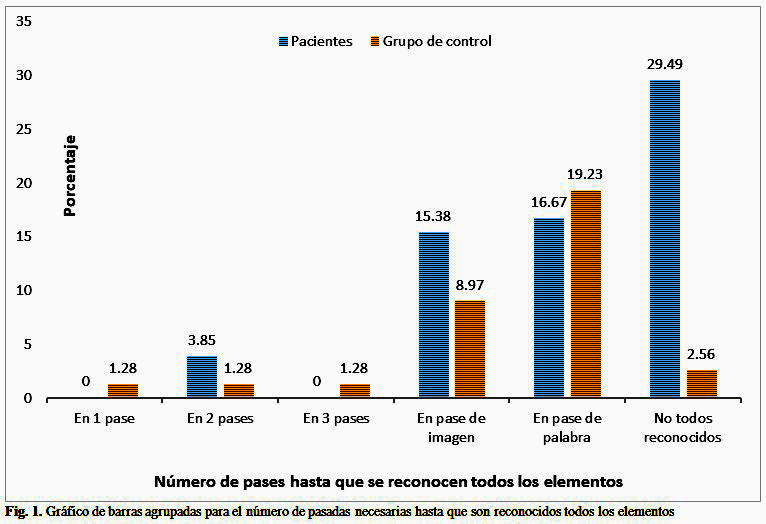
Los pacientes diferían significativamente de los sujetos de control en el número de intentos necesarios para reconocer todos los incisos (z = -2,422; p = 0,015*). El tamaño del efecto según Cohen fue d = 0,66, por tanto, corresponde a un efecto medio. Puede observarse que los pacientes reconocieron definitivamente todos los sonidos, especialmente en la "sesión de imágenes" en la que se presentaron cuatro imágenes. En cambio, la presentación de los sonidos en forma escrita en el "pasaje de palabras" hizo que más sujetos de control reconocieron todos los elementos del resultado final. (Fig. 1).
La comparación de subgrupos entre sujetos de control y pacientes emparejados por años de educación, para N = 27 cada uno, no mostró diferencias significativas en el número de intentos necesarios para reconocer todos los incisos (z = -1,173; p = 0,241).
Se calculó un análisis de sensibilidad posterior para determinar los tamaños del efecto que podrían detectarse en un estudio con un tamaño de muestra N y con probabilidades de error alfa y beta. Aquí se demostró que un texto de Wilcoxon con 27 participantes por grupo (N = 54) sería sensible a efectos de d de Cohen iguales a 0,92 con una potencia del 90 % (alfa = 0,05). Esto significa que el estudio no podría detectar de forma fiable efectos menores que d = 0,92 de Cohen. Si el efecto entre grupos fuera menor que d = 0,92 con un tamaño de muestra constante, no se detectaría de forma fiable. Con tamaños de muestra mayores, los efectos más pequeños podrían detectarse con mayor fiabilidad.
Resultados por rendimiento en la primera vuelta
El rendimiento en el reconocimiento de los sonidos en la primera serie difirió significativamente entre pacientes y sujetos de control. Los sujetos de control (M = 16,85; DE = 1,83) reconocieron más sonidos de dificultad media que los pacientes (M = 15,75; DE = 2,56). El tamaño del efecto fue d = 0,47 y se trata de un efecto medio.
No hubo diferencias significativas en el rendimiento de reconocimiento de sonidos en la primera pasada entre los pacientes con demencia asociada al Alzheimer (M = 15,9; DE = 2,53) y los pacientes con DCL (M = 15,3; DE = 2,83) (t (48) = 0,66; p = 0,52).
El rendimiento en el reconocimiento de los sonidos en la primera ejecución tras el emparejamiento para el período de entrenamiento no difirió significativamente entre los pacientes y los sujetos de control (t (45,08) = -2,20†; p = 0,071). Los sujetos de control (M = 16,85; DE = 1,83) reconocieron más sonidos de dificultad media que los pacientes (M = 15,67; DE = 2,77).
Un análisis de sensibilidad posterior a la prueba mostró que una prueba t independiente con 27 participantes por grupo (N = 54) sería sensible a efectos de d de Cohen = 0,90 con una potencia del 90 % (alfa = 0,05). Esto significa que el estudio no podría detectar de forma fiable efectos inferiores a la d de Cohen = 0,90.
Con respecto a la latencia hasta el reconocimiento de los sonidos en la primera ejecución, los pacientes y los sujetos de control no presentaban diferencias significativas entre sí (t (76) = 0,78, p= 0,439). Tras igualar el tiempo de entrenamiento, los pacientes y los sujetos de control tampoco presentaban diferencias significativas entre sí (t (52) = 0,53, p = 0,596).
Resultados según la dificultad de los sonidos
Un análisis de varianza bifactorial con medidas repetidas (esfericidad violada: Mauchly-W(5) = 0,65; p< 0,001***) mostró que la suma de sonidos reconocidos en la primera ejecución estaba relacionada con la dificultad (Greenhouse-Geisser F(2,35, 137,69) = 136,36; p < 0,001***; ηp2 = 0,64). Esto corresponde a un gran efecto. Las comparaciones por pares corregidas por Bonferroni mostraron que todos los niveles de dificultad eran significativamente diferentes entre sí (p < 0,001***). Por ejemplo, la suma de sonidos detectados para la dificultad fácil fue de M = 4,95; SE = 0,04 por encima del ruido moderado (M = 4,50; SE = 0,10).
Los sonidos de la nueva dificultad (M = 3,63; SE 0,08) se reconocieron con mayor frecuencia que los del nivel más difícil (M = 2,50; SE = 0,15), además, se produjo un efecto principal del grupo, lo que indica una diferencia significativa entre los grupos (F(1,76) = 5,20; p= 0,025*; ηp2 = 0,06). Esto corresponde a un efecto medio. La suma de sonidos detectados para el grupo de sujetos de control (M = 4,04; SE = 0,1) fue superior a la de los pacientes (M = 3,76; SE = 0,07).
En el análisis de varianza para la latencia media en la primera carrera (esfericidad violada: Mauchly-W(5) = 0,36; p < 0,001***), se encontró un efecto principal para la dificultad (Greenhouse-Geisser F(2,20, 154,20) = 70,39; p< 0,001***; ηp2 = 0,50), lo que corresponde a un efecto grande. En las comparaciones por pares corregidas por Bonferroni, todos los niveles de dificultad fueron significativamente diferentes entre sí a un nivel de p< 0,001***. Por tanto, la duración requerida para el nuevo nivel de dificultad fue la más larga (M = 10,86; SE = 0,53), seguido del nivel difícil (M = 8,02; SE = 0,57). Los sonidos del nivel de dificultad fácil (M = 3,90; SE = 0,15) se reconocieron con mayoe rapidez que los del nivel intermedio (M = 5,25; SE = 0,25). No se encontró un efecto principal para la pertenencia al grupo (F (1,70) = 0,275; p = 0,60).
Resultados por categoría de ruido
En un análisis de varianza de dos factores con medidas repetidas (esfericidad supuesta: Mauchly-W(2)= 0,97; p = 0,30), se encontró un efecto principal significativo para la categoría en la primera carrera (F(2, 152) = 12,72; p < 0,001***; ηp2 = 0,14). Esto corresponde a un gran tamaño del efecto. Las pruebas post-hoc corregidas por Bonferroni mostraron que la categoría naturaleza (M = 82,21; SE = 1,85) se detectó significativamente más a menudo que la categoría hogar (M = 75,27; SE = 2,39; p<0,001***), pero no que la categoría medio ambiente (M = 485,11; SE = 1,12; p = 0,98). A un nivel de p< 0,001***, la categoría de medio ambiente se reconoció significativamente más a menudo que la categoría de hogar.
Del mismo modo, se encontró un efecto principal significativo para el grupo (F (1, 76) = 3,98; p = 0,05*; ηp2 = 0,05), lo que corresponde a un efecto pequeño. Así, el porcentaje de sonidos reconocidos para el grupo de pacientes (M = 78,36; SE = 1,68) fue inferior al de los sujetos de control (M = 84,04; SE = 2,31).
Latencia media
Otro análisis de varianza de la latencia media de la primera pasada de las distintas categorías (esfericidad violada: Mauchly-W(2) = 0,75; p < 0,001***) mostró que el tiempo empleado en reconocer los sonidos dependía de la categoría de estos (Greenhouse-Geisser F(1,60, 120,25) = 22,68; p< 0,001***; ηp2 = 0,23). Esto corresponde a un gran tamaño del efecto. La prueba post-hoc corregida por Bonferroni mostró que la categoría Naturaleza (M = 6,52; SE = 0,34) requirió más tiempo que la categoría Hogar (M = 5,17; SE = 0,27) con una significación de p = 0,004**. La categoría Medio ambiente (M = 4,29; SE = 0,16) se detectó más rápido que Naturaleza (p < 0,001***) y Hogar (p = 0,003**). No se encontró ningún efecto principal para el grupo (F(1,75) = 0,188; p = 0,67).
Mejora de la coherencia interna para mejorar el test
Dado que todos los participantes reconocieron las categorías individuales, se volvieron a realizar algunos análisis estadísticos solo con los incisos que contribuyeron a mejorar la consistencia interna. Esto dio lugar a un aumento del tamaño del efecto para el rendimiento global de d = 0,47 a d = -0,51 y se trata de un efecto medio. En la evaluación de la dificultad, se produjo un efecto de interacción entre la dificultad media y la pertenencia al grupo. Para las categorías utilizados en el análisis de la mejora de la consistencia interna, las de dificultad media resultaron especialmente adecuadas para diferenciar la pertenencia a grupos.
Para el análisis de las categorías, se produjo una mejora del tamaño del efecto principal del grupo de ηp2 = 0,05 a ηp2 = 0,06 y, por tanto, un aumento de un efecto pequeño a medio.
DISCUSIÓN
Las dos cohortes mostraron rendimientos diferentes en la batería de pruebas CERAD. Este resultado, también, se observó en los análisis de subgrupos tras el emparejamiento para el período de entrenamiento. Esto concuerda con los hallazgos de numerosos estudios(7,8,9) e indica que el diagnóstico previo de los pacientes es válido. En pequeña medida, el mejor rendimiento de los sujetos de control podría explicarse por las mayores habilidades cognitivas adquiridas durante un período de entrenamiento más largo. Dado que hay un rendimiento auditivo periférico adecuado en las cohortes actuales, parece poco probable como explicación una comprensión instructiva reducida, inducida acústicamente, de las tareas y un rendimiento reducido asociado.
La hipótesis principal del estudio, según la cual existen diferencias entre los pacientes y los sujetos de control en cuanto a su rendimiento en el reconocimiento de sonidos ambientales no verbales, pudo aceptarse para el análisis principal. En general, los pacientes necesitaron más pases hasta reconocer todos los elementos. Asimismo, en esta cohorte no se reconocieron más sonidos, incluso, después de cinco rondas. Los sujetos de control reconocieron significativamente más sonidos en la primera ronda. No hubo diferencias en el reconocimiento de sonidos en la primera pasada entre los pacientes con DCL y demencia como síntomas de Alzheimer.
Después de igualar el tiempo de entrenamiento, no hubo diferencias significativas entre pacientes y controles en su rendimiento de reconocimiento. Una posible explicación es que el tiempo de entrenamiento tiene un efecto moderador en el rendimiento de reconocimiento en la prueba de sonido y que este efecto ya no puede representarse al controlar por el tiempo de entrenamiento. Así, el entrenamiento posiblemente impartiría una mayor capacidad de discriminación auditiva, que se refleja en el rendimiento de reconocimiento de los sonidos cotidianos, sin embargo, dado que se trata de efectos medios, es posible que la muestra reducida posteriormente no fuera lo suficientemente grande como para detectar efectos medios. Por lo tanto, futuros estudios necesitarían muestras más grandes o un emparejamiento a priori 2:1 de los grupos con respecto al tiempo de entrenamiento para detectar efectos más pequeños.
Se descartó la hipoacusia periférica como explicación del menor rendimiento de los pacientes, también, se descartó un trastorno de la denominación por las ejecuciones con presentación de imágenes y palabras. En conjunto, los resultados sugieren que los pacientes con EA padecían un trastorno auditivo central.
En cuanto a las pruebas basadas en el lenguaje, como las pruebas de escucha dicótica, varios estudios muestran ya una relación entre la demencia como síntoma del Alzheimer y los trastornos del procesamiento auditivo y perceptivo. Algunos autores encuentran evidencias de que las pruebas de procesamiento auditivo central basadas en el lenguaje son útiles para predecir la EA. Basándose en estos resultados, los autores consideraron que procesos neurodegenerativos similares subyacen a la presbiacusia central y a la disfunción ejecutiva.
Se sabe desde hace tiempo que los pacientes con demencia como síntoma del Alzheimer no solo tienen un procesamiento central disfuncional de los sonidos basados en el habla, también de los sonidos ambientales no verbales. Estos hallazgos encajan bien con los resultados del presente estudio y apoyan la tesis de que los pacientes con esta demencia tienen un trastorno de percepción y procesamiento auditivo no verbal.
La mayoría de los entornos auditivos surgen de una mezcla de sonidos diferentes que son variables en el tiempo y requieren un proceso cognitivo muy activo y complejo para percibirlos y decodificarlos.(10) Tanto los procesos descendentes, como el rastreo de flujos acústicos individuales y sus fuentes, descritos anteriormente en el problema del análisis de escenas auditivas, como los ascendentes, como la preminencia del estímulo objetivo, requieren estructuras corticales y subcorticales y atención. La EA desencadena un deterioro en el análisis auditivo de la escena que no se debe únicamente a pérdidas en la percepción del sonido o en las capacidades cognitivas generales.(10,11)
Investigaciones recientes muestran que la EA se caracteriza, entre otros elementos, por el deterioro de los lóbulos temporales mediales(12) y la reducción de la conectividad funcional entre las cortezas temporales anterior y medial.(13) Así, los patrones de daño en la EA y el AVSD son congruentes y proporcionan una explicación para el deterioro de los pacientes de Alzheimer en esta habilidad cognitiva. Como demostró el estudio, los pacientes con DCL y demencia como síntoma del Alzheimer se ven igualmente afectados en su rendimiento en la prueba de sonido. Este hecho indica que el procesamiento auditivo central se ve afectado al principio del curso de la EA y es un parámetro sensible.(14,15)
La hipótesis secundaria de que las dos cohortes muestran diferencias en el tiempo para reconocer los sonidos no pudo aceptarse, ya que la latencia para reconocer los sonidos en la primera ejecución no difirió significativamente entre las dos cohortes, ni en el análisis principal, ni en el análisis de subgrupos.
Es necesario seguir investigando sobre el diagnóstico del sonido ante el deterioro cognitivo leve en la EA para ilustrar con mayor claridad el alcance del deterioro en esta área y cuando se ve comprometido el reconocimiento del sonido en el curso de la enfermedad. Un mayor conocimiento de las regiones anatómicas afectadas podría arrojar luz sobre cómo se entrelazan las actividades de la vida diaria y la EA. Podrían encontrarse nuevos enfoques de investigación e intervención en relación con el reconocimiento de sonidos, las habilidades de orientación y la participación social de los individuos afectados.
La falta de reconocimiento y comprensión del entorno acústico puede resultar amenazadora y contribuir a una mayor desorientación y provocar el retraimiento social. La falta de reconocimiento del entorno social puede conducir a acciones y reacciones erróneas. Los miedos e inseguridades preexistentes pueden intensificarse, sobre todo, en entornos desconocidos y nuevos, como un traslado a una residencia o a un hospital, por lo que la desorientación puede acentuarse. Esto puede convertirse en parte de un círculo vicioso en el que un mayor retraimiento de la participación en la vida cotidiana a su vez conduce a una menor capacidad de respuesta mental y activación de las influencias externas, lo que nuevamente puede conducir a un empeoramiento de la EA.(14)
Esto puede abordarse por intervención, posiblemente al proporcionar algún tipo de formación para reconocer los sonidos ambientales relevantes, al reducir la exposición a los sonidos o al adaptar el entorno para reducir la amenaza y la desorientación, de modo que se facilite de nuevo la participación.
Hubo un efecto principal de la dificultad para reconocer los sonidos en la primera pasada y un efecto principal de la pertenencia a un grupo. En orden descendente, se reconocieron significativamente menos elementos en la dificultad fácil, la dificultad media, la dificultad nueva y la dificultad difícil. Los sujetos de control siempre fueron capaces de identificar correctamente más elementos que los pacientes, independientemente del nivel de dificultad.
La latencia para reconocer los sonidos difirió significativamente en todos los niveles de dificultad. Los sonidos del nivel de dificultad fácil fueron reconocidos con mayor rapidez, mientras que en orden ascendente se tardó más en reconocer los sonidos de dificultad media, difícil y nueva. No se pudo constatar un efecto principal del grupo.
Esto demostró que los sonidos difieren en su dificultad y que la clasificación en los distintos niveles de dificultad es válida. En el futuro, podría hacerse una estimación de la gravedad de la demencia en función del nivel de dificultad alcanzado. Para poder investigar claramente esta posibilidad, es necesario seguir investigando acerca del desarrollo de pruebas adaptadas a la dificultad.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González.
2. Curación de datos: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González.
3. Análisis formal: Manuel Conrado Ezcurdia Bárzaga.
4. Adquisición de fondos: Esta investigación no contó con adquisición de fondos.
5. Investigación: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González, Juan Pablo Haro Romero.
6. Metodología: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González, Juan Pablo Haro Romero.
7. Administración del proyecto: Manuel Conrado Ezcurdia Bárzaga.
8. Recursos: Juan Pablo Haro Romero.
9. Software: Juan Pablo Haro Romero.
10. Supervisión: Manuel Conrado Ezcurdia Bárzaga.
11. Validación: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González.
12. Visualización: Juan Pablo Haro Romero.
13. Redacción del borrador original: Manuel Conrado Ezcurdia Bárzaga, Elsy Labrada González.
14. Redacción, revisión y edición: Manuel Conrado Ezcurdia Barzaga, Elsy Labrada González, Juan Pablo Haro Romero.
REFERENCIAS BIBLIOGRÁFICAS
- Reiman EM, Arboleda JF, Quiroz YT, Huentelman MJ, Beach TG, Caselli RJ, et al. Exceptionally low likelihood of Alzheimer’s dementia in APOE2 homozygotes from a 5,000-person neuropathological study. Nat Commun. 2020;11(667):1-11 [Buscar en Google Scholar]
- Gao S, Burney HN, Callahan CM, Purnell CE, Hendrie HC. Incidence of dementia and Alzheimer disease over time: A meta-analysis: Incidence rates of dementia and Alzheimer disease. J Am Geriatr Soc. 2019;67(7):1361-9 [Buscar en Google Scholar]
- Platel H, Lechevalier B, Descat C, Lambert J, Eustache F. Agnosias auditivas y síndromes relacionados. EMC-Otorrinolaringol [Internet]. 2018 [citado 21 Jun 2023];47(4):[aprox. 10p]. Disponible en: https://www.sciencedirect.com/science/article/pii/S1632347518413550 [Buscar en Google Scholar]
- Fillenbaum GG, van Belle G, Morris JC, Mohs RC, Mirra SS, Davis PC, et al. Consortium to Establish a Registry for Alzheimer’s Disease (CERAD): the first twenty years. Alzheimers Dement. 2008;4(2):96-109 [Buscar en Google Scholar]
- Molina CV, Ramírez AA. Propiedades psicométricas de la escala de depresión geriátrica: revisión sistemática. Conc Digital [Internet]. 2023 [citado 21 Jun 2023];6(1):[aprox. 15p]. Disponible en: https://www.cienciadigital.org/revistacienciadigital2/index.php/ConcienciaDigital/article/view/2479 [Buscar en Google Scholar]
- Stilp CE, Assgari AA. Perceptual sensitivity to spectral properties of earlier sounds during speech categorization. Atten Percept Psychophys. 2018;80(5):1300-10 [Buscar en Google Scholar]
- Aguirre DC, Gómez RD, Moreno S, Henao E, Motta M, Muñoz C, et al. Validez y fiabilidad de la batería neuropsicológica CERAD-Col. Rev Neurol [Internet]. 2007 [citado 21 Jun 2023];45(11):[aprox. 5p]. Disponible en: https://pesquisa.bvsalud.org/portal/resource/pt/ibc-65823 [Buscar en Google Scholar]
- Sotaniemi M, Pulliainen V, Hokkanen L, Pirttilä T, Hallikainen I, Soininen H, et al. CERAD-neuropsychological battery in screening mild Alzheimer’s disease: CERAD-nb in screening mild Alzheimer’s disease. Acta Neurol Scand. 2012;125(1):16-23 [Buscar en Google Scholar]
- Wilson RS, Yu L, Lamar M, Schneider JA, Boyle PA, Bennett DA, et al. Education and cognitive reserve in old age [Internet]. Minnesota: American Academy of Neurology; 2019 [citado 21 Jun 2023]. Disponible en: https://n.neurology.org/content/92/10/e1041 [Buscar en Google Scholar]
- Johnson J, Marshall CR, Weil RS, Bamiou DE, Hardy C, Warren JD, et al. Hearing and dementia: from ears to brain. Brain. 2021;144(2):391-401 [Buscar en Google Scholar]
- Coebergh JA, McDowell S, van Woerkom T, Koopman JP, Mulder J, Bruijn S, et al. Auditory Agnosia for environmental sounds in Alzheimer’s disease: Not hearing and not listening?. J Alzheimers Dis. 2020;73(4):1407-19 [Buscar en Google Scholar]
- Grajski KA, Bressler SL. Alzheimer’s Disease Neuroimaging Initiative. Differential medial temporal lobe and default-mode network functional connectivity and morphometric changes in Alzheimer’s disease. NeuroImage Clin. 2019;23(101860):3-53 [Buscar en Google Scholar]
- De Flores R, Das SR, Xie L, Wisse LEM, Lyu X, Shah P, et al. Medial temporal lobe networks in Alzheimer’s disease: Structural and molecular vulnerabilities. J Neurosci. 2022;42(10):2131-41 [Buscar en Google Scholar]
- Swords GM, Nguyen LT, Mudar RA, Llano DA. Auditory system dysfunction in Alzheimer disease and its prodromal states: A review. Ageing Res Rev. 2018;44(10):49-59 [Buscar en Google Scholar]
- Homson RS, Auduong P, Miller AT, Gurgel RK. Hearing loss as a risk factor for dementia: A systematic review: Hearing Loss and Dementia Systematic Review. Laryngoscope Investig Otolaryngol. 2017;2(2):69-79 [Buscar en Google Scholar]
Enlaces refback
- No hay ningún enlace refback.
FINLAY EN: 








FINLAY CERTIFICADA POR:

Esta revista "no aplica" cargos por publicación en ninguna etapa del proceso editorial.
Dirección postal: Calle 51A y Avenida 5 de Septiembre Cienfuegos, Cuba Código postal: 55100.
http://www.revfinlay.sld.cu
Telefono: +53 43 516602. Telefax: +53 43 517733.
amgiraldoni@infomed.sld.cu
ISSN: 2221-2434
RNPS: 5129